-
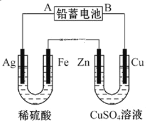
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④ B.①③④② C.③④②① D.③①②④
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.碱性锌锰电池是二次电池
B.铅蓄电池是一次电池
C.二次电池又叫蓄电池,它放电后可以再充电使活性物质获得再生
D.燃料电池的活性物质大量储存在电池内部
难度: 简单查看答案及解析
-
用电解法提取氯化铜废液中的铜,方案正确的是( )
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物
D.用带火星的木条检验阳极产物
难度: 中等查看答案及解析
-
下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极 B.金属护拦表面涂漆
C.汽车底盘喷涂高分子膜 D.地下钢管连接镁块
难度: 中等查看答案及解析
-
下列反应不可用于设计原电池的是( )
A.NaOH+HCl=NaCl+H2O B.2CH3OH+3O2
2CO2+4H2O
C.Zn+2HCl=ZnCl2+H2↑ D.4Al+3O2+6H2O=4Al(OH)3
难度: 简单查看答案及解析
-
下列装置可以构成原电池的是
A.
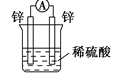 B.
B.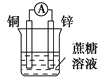
C.
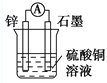 D.
D.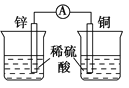
难度: 简单查看答案及解析
-
随着人们生活质量的日益提高,废旧电池已成为一个亟待解决的问题,对废旧电池的处理体现了对资源和环境的可持续发展。人们处理废旧电池的主要目的是
A.回收电池外壳的金属材料
B.回收电池中的二氧化锰
C.回收电池中的石墨电极
D.防止电池中的重金属汞、镉、铅对土壤、水源的污染
难度: 简单查看答案及解析
-
有关原电池的下列说法中正确的是( )
A.在外电路中电子由正极流向负极 B.在原电池中负极发生还原反应
C.阳离子向正极方向移动 D.原电池中正极一定是不活泼金属
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.锌跟稀硫酸反应制取氢气,加入少量的硫酸铜能加快反应速率
B.镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易被腐蚀
C.钢铁表面常易被锈蚀生成Fe2O3·nH2O
D.钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应
难度: 简单查看答案及解析
-
X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是( )
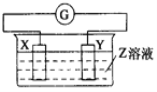
选项
X
Y
Z
A
Zn
Cu
稀硫酸
B
Cu
Zn
稀硫酸
C
Cu
Ag
硫酸铜溶液
D
Ag
Zn
硝酸银溶液
A.A B. B C. C D. D
难度: 中等查看答案及解析
-
微型锂碘电池可用做植入某些心脏病人体内的心脏起搏器所用的电源。这种电池中的电解质是固体电解质LiI,其中的导电离子是I-。下列有关说法正确的是
A.正极反应:2Li-2e-=2Li+
B.负极反应:I2+2e-=2I-
C.总反应是:2Li+I2=2LiI
D.金属锂作正极
难度: 中等查看答案及解析
-
一种充电电池放电时的电极反应为
;
,当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A.
的还原 B.
的氧化
C.
的氧化 D.
的氧化
难度: 中等查看答案及解析
-
钮扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为Zn+2OH--2e-=Zn(OH)2、Ag2O+H2O+2e-=2Ag+2OH-,下列说法中,正确的是( )
A.锌是负极,氧化银是正极
B.锌发生还原反应,氧化银发生氧化反应
C.溶液中OH-向正极移动,K+、H+向负极移动
D.在电池放电过程中,电解质溶液的酸碱性基本保持不变
难度: 简单查看答案及解析
-
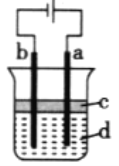
如图所示是探究铁发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法中不正确的是( )
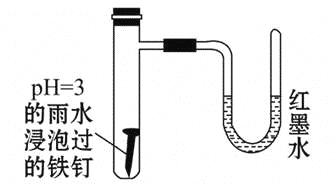
A.开始时发生的是析氢腐蚀
B.一段时间后发生的是吸氧腐蚀
C.两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
D.析氢腐蚀的总反应式为2Fe+O2+2H2O=2Fe(OH)2
难度: 中等查看答案及解析
-
铜锌原电池(如下图)工作时,下列叙述正确的是( )
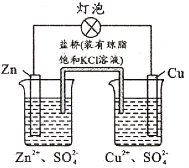
A.正极反应为:
B.电池反应为:
C.在外电路中,电子从
流向Zn D.盐桥中的
移向
溶液
难度: 简单查看答案及解析
-
关于下列各装置图的叙述中,不正确的是
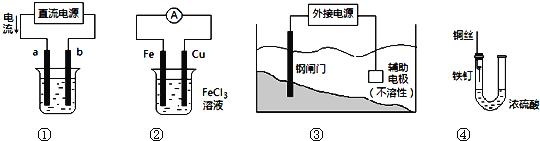
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
锂电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。某种锂电池的总反应为:Li+MnO2=LiMnO2,下列说法正确的是( )
A.锂是正极,电极反应为:Li-e-=Li+ B.锂是负极,电极反应为:Li-e-=Li+
C.锂是负极,电极反应为:MnO2+e-=MnO
D.锂是负极,电极反应为:Li-2e-=Li2+
难度: 中等查看答案及解析
-
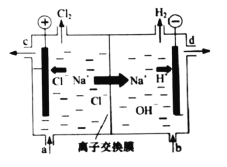
将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流,此装置称为甲烷燃料电池。下列叙述中正确的是( )
①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式为:CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动。
A.①③⑤ B.②④⑥ C.④⑤⑥ D.①②③
难度: 中等查看答案及解析
-
下列图示中关于铜电极的连接错误的是
A.
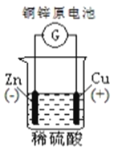 B.
B.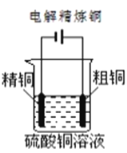
C.
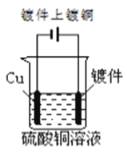 D.
D.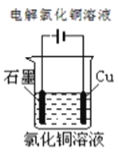
难度: 中等查看答案及解析
-
全钒液流电池以惰性材料作电极,在电解质溶液中发生的电池总反应为VO2++H2O+V3+
VO2++V2++2H+。在电池放电过程中,正极附近溶液的pH( )
A.增大 B.减小 C.不变 D.无法判断
难度: 中等查看答案及解析
-
图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
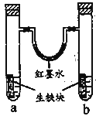
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是
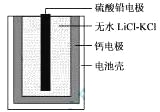
A.正极反应式:Ca + 2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.每转移0.1mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
难度: 困难查看答案及解析