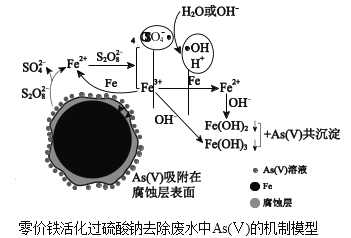
-
从石油原料到口罩的生产过程中涉及的下列变化不属于化学变化的是( )
A
B
C
D




石油催化裂解得到丙烯
丙烯催化聚合生成聚丙烯
聚丙烯熔融后喷丝压成熔喷布
利用环氧乙烷与微生物蛋白质发生烷基化反应消毒
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列说法正确的是( )
①酿酒过程中,葡萄糖可通过水解反应生成酒精
②鸡蛋清溶液中加入饱和硫酸钠溶液,生成的沉淀物不能再溶解
③紫色酸性高锰酸钾溶液中加入植物油充分振荡后,溶液颜色会褪去
④粮食中富含淀粉,与纤维素组成相同,互为同分异构体
⑤疫苗未冷储而失效可能与蛋白质变性有关
⑥尼龙绳、橡皮筋和纯棉衬衣都属于合成纤维制品
A.①③⑤ B.③ C.②④⑥ D.③⑤
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.饱和Na2CO3溶液与CaSO4固体反应:CO
+CaSO4=CaCO3+SO
B.酸化NaIO3和NaI的溶液混合:I-+IO
+6H+=I2+3H2O
C.KClO碱性溶液与Fe(OH)3反应:3ClO-+2Fe(OH)3=2FeO
+3Cl-+4H++H2O
D.电解饱和食盐水:2Cl-+2H+
Cl2↑+H2↑
难度: 简单查看答案及解析
-
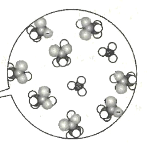
下列说法不正确的是( )
A.电解水时氢气与氧气的体积比为2:1,原因是气体的体积主要取决于分子间距,而同温同压时气体的间距基本相等
B.碳酸分步电离以第一步为主,第二步为次,原因之一是第二步电离时碳酸氢根带负电荷,而电离出的氢离子为正电荷
C.苯酚显弱酸性可与氢氧化钠溶液反应,是因为羟基活化了苯环
D.可通过如图(比例模型)判定醋酸是弱电解质
难度: 中等查看答案及解析
-
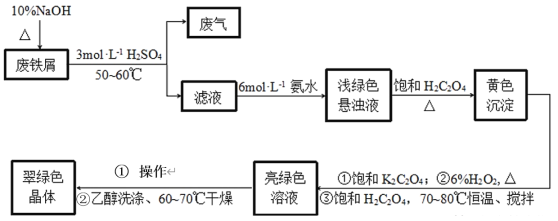
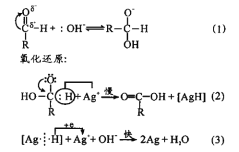
某化学兴趣小组对教材中乙醇氧化及产物检验的实验进行了改进和创新,其改进实验装置如图所示,按图组装好仪器,装好试剂。下列有关改进实验的叙述不正确的是( )
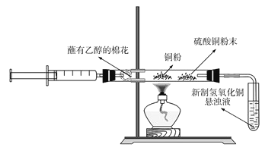
A.点燃酒精灯,轻轻推动注射器活塞即可实现乙醇氧化及部分产物的检验
B.铜粉黑红变化有关反应为2Cu+O2
2CuO、C2H5OH+CuO
CH3CHO+Cu+H2O
C.硫酸铜粉末变蓝,说明乙醇氧化反应生成了水
D.新制氢氧化铜悬浊液配制方法是将6滴2%的氢氧化钠溶液加入到2mL10%的硫酸铜溶液中
难度: 简单查看答案及解析
-
CO甲烷化反应为:CO(g)+3H2(g)=CH4(g)+H2O(l)。如图是使用某种催化剂时转化过程中的能量变化(部分物质省略),其中步骤②反应速率最慢。
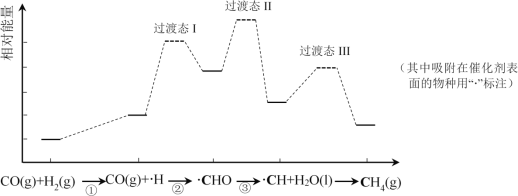
下列说法不正确的是( )
A.步骤①只有非极性键断裂
B.步骤②速率最慢的原因可能是其活化能最高
C.步骤③需要吸收热量
D.使用该催化剂不能有效提高CO的平衡转化率
难度: 中等查看答案及解析
-
科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,具有高效的催化性能,其分子结构示意图如图。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是( )
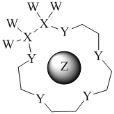
A.Y单质的氧化性在同主族中最强
B.离子半径:Z>Y
C.Z与Y可组成多种离子化合物
D.氢化物的热稳定性:Y>X
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.乙烯和环丙烷(C3H6)组成28g混合气体中含有4NA个氢原子
B.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64g
C.标准状况下,22.4升CH2Cl2中共价键的数目为4NA
D.2L1mol·L-1的盐酸中所含HCl分子数约为2NA
难度: 中等查看答案及解析
-
实验室模拟工业处理含铬废水,操作及现象如图1,反应过程中铬元素的化合价变化如图2。下列说法正确的是( )

已知:深蓝色溶液中生成了CrO5。
A.实验开始至5s,铬元素被氧化
B.实验开始至30s,溶液中生成Cr3+的总反应离子方程式为:Cr2O
+3H2O2+8H+=2Cr3++7H2O+3O2↑
C.30s至80s的过程,一定是氧气氧化了Cr3+
D.80s时,溶液中又生成了Cr2O
,颜色相比于开始时浅,是水稀释所致
难度: 困难查看答案及解析
-
常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。
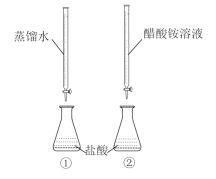
下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
难度: 中等查看答案及解析
-
“化学实验→观察现象→分析推理→得出结论”是化学学习的方法。下列说法正确的是( )
A.证明某红棕色气体是溴蒸气还是NO2,可用湿润的淀粉–KI试纸检验,观察试纸颜色变化
B.验证淀粉的水解产物是否具有还原性,取酸性水解液于试管中并加入新制氢氧化铜悬浊液,加热煮沸,观察是否出现砖红色沉淀
C.向铝质容器中加入食盐溶液,再将变黑(Ag2S)的银器浸入该溶液中,一段时间后发现黑色褪去,该过程中发生的反应为2Al+3Ag2S=6Ag+Al2S3
D.将SO2通入足量稀Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变成棕黄色,假设通入的SO2完全反应,则同温同压下,逸出的NO气体和SO2的体积比为2:3
难度: 中等查看答案及解析
-
第三代混合动力车目前一般使用镍氢电池(M表示储氢合金;汽车在刹车或下坡时,电池处于充电状态)。镍氢电池充放电原理的示意图如下:

其总反应式为
 。根据所给信息判断,下列说法错误的是
。根据所给信息判断,下列说法错误的是A.混合动力汽车上坡或加速时,乙电极的电极反应式为:NiOOH+H2O+eˉ==Ni(OH)2+OHˉ
B.混合动力汽车上坡或加速时,电解液中OHˉ向甲电极移动
C.混合动力汽车下坡或刹车时,甲电极周围溶液的pH减小
D.混合动力汽车下坡或刹车时,电流的方向为:甲电极→发动机→乙电极
难度: 困难查看答案及解析
-
已知:常温下邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是( )
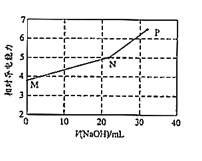
A.M点离子浓度:c(K+)>c(HA-)>c(H2A)>c(A2-)
B.N点溶液中存在:c(Na+)+c(K+)>2c(A2-)+2c(HA-)
C.P点溶液中一定存在:c(Na+)>c(K+)>c(OH-)>c(A2-)
D.从M到P之间的任一点均存在:c(Na+)+c(K+)+c(H+)=c(A2-)+c(HA-)+c(OH-)
难度: 困难查看答案及解析
-
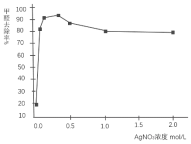
某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号
①
②
③
装置



现象
小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化
两极均产生气泡,溶液无明显变化
两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
难度: 中等查看答案及解析