-
一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响生成氢气的量,可向其中加入( )
A.KCl固体 B.铁粉 C.K2SO4溶液 D.KNO3溶液
难度: 简单查看答案及解析
-
把下列4种X溶液,分别加入到4个盛有10mL2mol·L-1盐酸的烧杯中,并加水稀释到50mL,此时X与盐酸缓缓地进行反应,其中反应速率最大的是( )
A.20mL,3mol·L-1 B.20mL,2mol·L-1 C.10mL,4mol·L-1 D.10mL,2mol·L-1
难度: 简单查看答案及解析
-
NO和CO都是汽车尾气里的有毒气体,它们之间能缓慢反应生成N2和CO2,对于该反应的下列说法不正确的是
A.增大压强能增大反应速率 B.使用适当催化剂可增大反应速率
C.升高温度能增大反应速率 D.增大压强(体积减小)对该反应速率无影响
难度: 中等查看答案及解析
-
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
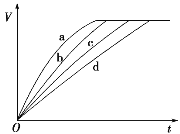
组别
对应曲线
c(HCl)/ mol·L-1
反应温度/℃
铁的状态
1
a
30
粉末状
2
b
30
粉末状
3
c
2.5
块状
4
d
2.5
30
块状
A.第4组实验的反应速率最慢 B.第1组实验中盐酸的浓度可能大于2.5 mol·L-1
C.第2组实验中盐酸的浓度可能等于2.5 mol·L-1 D.第3组实验的反应温度低于30 ℃
难度: 中等查看答案及解析
-
下列四个试管中发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
试管
盐酸浓度
温度
锌的状态
A
0.5mol•L﹣1
30℃
块 状
B
0.5mol•L﹣1
30℃
粉末状
C
1mol•L﹣1
35℃
块 状
D
1mol•L﹣1
35℃
粉末状
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
改变外界条件可以影响化学反应速率,针对H2(g)+I2(g)
2HI(g),其中能使活化分子百分数增加的是
①增加反应物浓度 ②增大气体的压强 ③升高体系的温度 ④使用催化剂
A. ①② B. ②③ C. ①④ D. ③④
难度: 中等查看答案及解析
-
在气体反应中,改变条件:①增大反应物的浓度,②升高温度,③增大压强,④移去生成物,⑤加入催化剂。能使反应物中活化分子数和活化分子的百分数同时增大的方法是( )
A.①⑤ B.①③ C.②⑤ D.③⑤
难度: 简单查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①③ D.②④
难度: 简单查看答案及解析
-
设反应C+CO2
2CO(正反应吸热)反应速率为v1,N2+3H2
2NH3(正反应放热),反应速率为v2。对于上述反应,当温度升高时,v1、v2的变化情况为( )
A.同时增大 B.同时减小 C.v1增大,v2减小 D.v1减小,v2增大
难度: 中等查看答案及解析
-
下列措施能明显增大原反应的化学反应速率的是( )
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与铁反应制取H2
C.在H2SO4与NaOH两溶液反应时,增大压强
D.恒温恒容条件下,在工业合成氨反应中,增加氮气的量
难度: 简单查看答案及解析
-
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示。在下列因素中对产生H2速率有影响的是( )
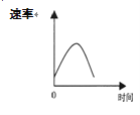
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①②③ D.②③
难度: 中等查看答案及解析
