-
下列说就正确的是
A. 甲苯的一氯代物有3种 B. 乙烯通入溴的CCl4溶液中,发生加成反应
C. 乙醇不能使酸性高锰酸钾溶液褪色 D. 可以用NaOH溶被来分离乙酸和乙酸乙酯
难度: 中等查看答案及解析
-
下列有关物质性质的比较顺序中,不正确的是 ( )
A. 晶格能大小顺序:NaCl < NaF< CaO<MgO
B. 酸性: HClO4>H2SO4>H3PO4>H2SiO3
C. 微粒半径: K+>Ca2+>Cl->S2-
D. 热稳定性:HF>HCl>HBr>HI
难度: 简单查看答案及解析
-
下列属于吸热反应的是( )
A. 镁的燃烧反应 B. 盐酸与氢氧化钠的反应
C. 水的分解反应 D. 铝与盐酸的反应
难度: 简单查看答案及解析
-
下列说法正确的是:
A. 聚乙烯可以使酸性高锰酸钾溶液褪色
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共可以消耗氯气 5mol
C. 油脂、糖类和蛋白质都能发生水解反应
D. 制取溴苯:将铁屑、溴水、苯混合加热
难度: 中等查看答案及解析
-
A、B是短周期元素,最外层电子排布式分别为3s2,2s22p3。A与B形成的离子化合物加蒸馏水溶解后可使酚酞试液变红,同时有气体逸出,该气体可使湿润的红色石蕊试纸变蓝,则该化合物的分子量是
A.38 B.55 C.100 D.135
难度: 简单查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是( )
A.SO3 与SO2 B.BF3 与NH3 C.BeCl2与SCl2 D.H2O 与SO2
难度: 中等查看答案及解析
-
下列过程中发生了取代反应的是( )
A.苯加入溴水中,振荡并静置后下层液体变为无色
B.在催化剂作用下乙烯生成聚乙烯
C.在铜催化、加热条件下,乙醇与氧气反应
D.乙醇和乙酸在浓硫酸作用下加热生成乙酸乙酯
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 某微粒核外电子排布为2、8、8结构,则该微粒一定氩原子
B. 最外层电子达到稳定结构的微粒只能是稀有气体的原子
C. F-、Na+、Mg2+、Al3+与Ne原子具有相同电子层结构的离子
D. 某元素原子的最外层只有2个电子,则该元素一定是金属元素
难度: 中等查看答案及解析
-
在气相中,关于BeF2和SF2的说法错误的是( )
A.BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2
B.BeF2分子的立体结构为直线形
C.SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子
D.在气相中,BeF2是直线形而SF2是V形
难度: 中等查看答案及解析
-
下列粒子属于等电子体的是( )
A.CH4和NH
B.NO和O2 C.NH
和H3O+ D.HCl和H2O
难度: 简单查看答案及解析
-
关于氢键,下列说法正确的是
A.H2O是一种非常稳定的化合物,这是由于氢键所致
B.氯化钠易溶于水是因为形成了氢键
C.氨易液化与氨分子间存在氢键无关
D.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键
难度: 中等查看答案及解析
-
下列物质中肯定不含有离子键的是( )
A.氧化物 B.强酸 C.强碱 D.盐类
难度: 简单查看答案及解析
-
如图是Mn和Bi形成的某种晶体的晶胞结构示意图,则该晶体的化学式可表示为( )
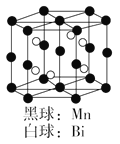
A.Mn4Bi3
B.Mn2Bi
C.MnBi
D.MnBi3
难度: 中等查看答案及解析
-
下列物质中,属于含有极性共价键的离子晶体的是
A.CsCl B.KOH C.H2O D.Na2O2
难度: 简单查看答案及解析
-
下列比较正确的是()
A.化学键的键能由大到小:金刚石>碳化硅>硅
B.熔沸点由高到低:氯化钠>氧化镁>金刚石>二氧化碳
C.硬度由大到小:C60>碳化硅>铁>氯化钠
D.共价键的极性由强到弱:H-I>H-Br>H-Cl
难度: 简单查看答案及解析
-
高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是
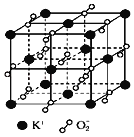
A.晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B.晶体中与每个K+距离最近的K+有8个
C.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D.晶体中,0价氧与﹣2价氧的数目比为2:1
难度: 中等查看答案及解析
-
在一定条件下,下列与有机物的结构、性质有关的叙述正确的是( )
A.C3H2Cl6有四种同分异构体
B.甲苯分子中所有原子可能共面
C.苯、乙醇、油脂均不能使酸性 KMnO4溶液褪色
D.分子式为C5H12O且可与金属钠反应放出氢气的有机物有3种
难度: 中等查看答案及解析
-
在 2A(g) + B(g) ===3C(g) + 4D(g)反应中,下面表示的反应速率最快的是
A.v (A)=0.5mol/(L∙s) B.v(B)=1.8 mol/(L∙min) C.v (C)=0.8mol/(L∙s) D.v(D)=1.0 mol/(L∙s)
难度: 简单查看答案及解析
-
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)⇌xC(g)+2D(g),经2min后测得D的浓度为0.5 mol·L-1,c(A)∶c(B)=3∶5,以C表示的平均速率v(C)=0.25 mol·L-1·min-1,下列说法正确的是
A.该反应方程式中,x=1
B.2 min时,A的物质的量为0.75mol
C.2 min时,A的转化率为50%
D.反应速率v(B)=0.25 mol·L-1·min-1
难度: 困难查看答案及解析