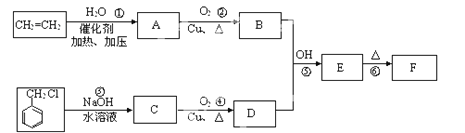
-
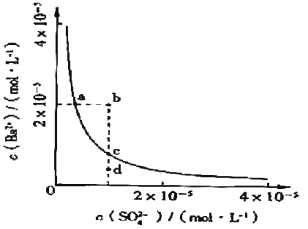
常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是:( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
难度: 简单查看答案及解析
-
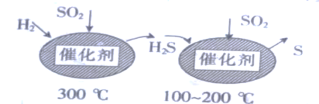
《中华人民共和国食品安全法》于2009年6月1日起实施。下列做法不利于食品安全的是:
A.用聚氯乙烯塑料袋包装食品
B.在食用盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
难度: 中等查看答案及解析
-
下列说法错误的是
A.乙醇和乙酸都是常用调味品的主要成分
B.乙醇和乙酸的沸点和熔点都比乙烷和乙烯的沸点和熔点高
C.乙醇和乙酸都能发生氧化反应
D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为可逆反应
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.四氯化碳分子比例模型:
B.COS的电子式是
C.次氯酸的结构式为H-Cl-O
D.
O2-离子结构示意图:
难度: 简单查看答案及解析
-
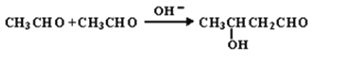
下列有机物命名正确的是 ( )
A.
2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇
C.
间二甲苯 D.
2—甲基—2—丙烯
难度: 中等查看答案及解析
-
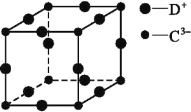
X、Y为短周期元素,X的原子半径小于Y。下列叙述正确的是( )
A.原子序数Y大于X
B.X元素的最高正价一定大于Y元素的最高正价
C.若X元素形成的单质是X2,Y元素的单质一定是Y2
D.若X、Y原子电子层数相同,Y的失电子能力一定强于X
难度: 简单查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g) ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
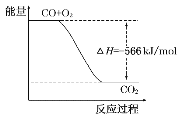
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH=-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
(NH4)2PtCl6 晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂。在此分解反应中,还原产物与氧化产物的物质的量之比是( )
A.2∶3 B.1∶3 C.4∶3 D.3∶2
难度: 简单查看答案及解析
-
下列实验现象的描述错误的是( )
A.氢气在氯气中燃烧生成绿色烟雾
B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
C.点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰
D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
难度: 简单查看答案及解析