-
短周期元素X、Y、Z、W的原子序数依次增大。X的原子半径比Y的小,且X与Y的最外层电子数之和等于Z的最外层电子数。X与W同主族,Z是地壳中含量最高的元素。下列说法不正确的是
A. 原子半径的大小顺序:r(W)>r(Y)>r(Z)>r(X)
B. 元素Z、W的简单离子的电子层结构相同
C. 元素Y的简单气态氢化物的热稳定性比Z的强
D. X、Y两种元素可形成分别含有10e-和18e-的化合物
难度: 中等查看答案及解析
-
下列变化过程中不涉及化学反应的是( )
A.陶瓷的烧制 B.活字印刷排版术
C.鞭炮和烟火的燃放 D.司母戊鼎表面出现铜绿
难度: 简单查看答案及解析
-
下列说法正确的是
A.血红蛋白、牛胰岛素、蚕丝、人造奶油充分水解后均可得到氨基酸
B.李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法
C.测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振谱、同位素示踪法等
D.色谱法通常用于分离结构相近、物理性质和化学性质相似的物质,纸层析法就是一种简单的色谱分析法
难度: 中等查看答案及解析
-
下列曲线表示卤素元素某种性质随核电荷数的变化趋势,正确的是
A.
B.
C.
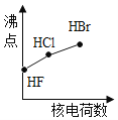 D.
D. 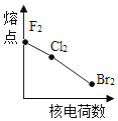
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.23gNa与足量H2O反应完全后可生成NA个H2分子
B.1molCu和足量热浓硫酸反应可生成NA个SO3分子
C.标准状况下,22.4L N2和H2混合气中含NA个原子
D.3mol单质Fe完全转变为Fe3O4,失去8NA个电子
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.在100 mL 1 mol⸱L−1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++
+4H+
B.在100 mL 2 mol⸱L−1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl-
C.向NaHCO3溶液中加入过量的澄清石灰水:2
+Ca2++2OH-═CaCO3↓+2H2O+
D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2
+2Ba2++4OH-═2BaSO4↓+
+2H2O
难度: 简单查看答案及解析
-
研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是
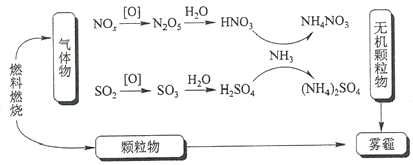
A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
难度: 简单查看答案及解析
-
色氨酸是植物体内生长素生物合成重要的前体物质,普遍存在于高等植物中。纯净的色氨酸为白色或微黄色结晶,微溶于水易溶于盐酸或氢氧化钠,其结构如图所示,下列关于色氨酸的说法不正确的是
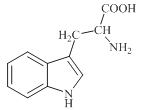
A.色氨酸的分子式为C11H12N2O2
B.色氨酸能发生取代、加成、酯化、中和反应
C.色氨酸微溶于水而易溶于酸或碱溶液是因为其与酸、碱都能反应生成盐
D.将色氨酸与甘氨酸(NH2CH2COOH)混合,在一定条件下最多可形成三种二肽
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
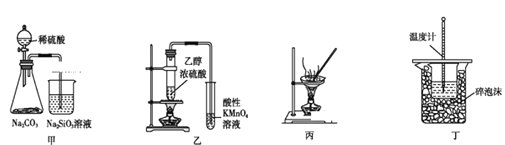
A.图甲装置可证明非金属性强弱:S>C>Si
B.图乙装置可用于检验有乙烯生成
C.图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体
D.图丁装置可用来测定中和热
难度: 中等查看答案及解析
-
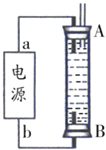
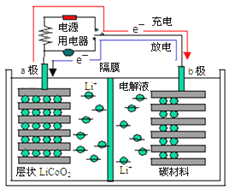
微生物电池可用于有机废水的处理,如图是利用微生物处理含尿素[CO(NH2)2]废水的装置。下列说法中正确的是
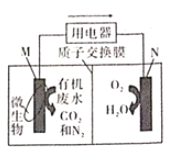
A.该装置外电路中箭头的方向代表电流的方向
B.M电极反应式为CO(NH2)2-6e-+H2O=CO2↑+6H++N2↑
C.当有1mlH+通过质子交换膜时,N极消耗5.6LO2
D.该处理工艺会导致废水酸性增强,仍旧不能直接排放
难度: 中等查看答案及解析
-
电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.100 mol·L-1 NH3·H2O滴定10 mL浓度均为0.100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。
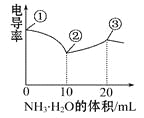
下列说法正确的是
A.①溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl-)>c(CH3COO-)
D.③点后因离子数目减少使电导率略降低
难度: 中等查看答案及解析
-
研究表明,在催化剂a(或催化剂b)存在下,CO2和H2能同时发生两个平行反应,反应的热化学方程式如下:
① CO2(g)+ 3H2(g)
CH3OH(g)+ H2O(g) ΔH1= − 53.7 kJ/mol
② CO2(g)+ H2(g)
CO(g)+ H2O(g) ΔH2= + 41.2 kJ/mol
某实验小组控制CO2和H2初始投料比为1∶2.2。在相同压强下,经过相同反应时间测得的实验数据如下:
实验编号
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
1
543
催化剂a
12.3
42.3
2
543
催化剂b
10.9
72.7
3
553
催化剂a
15.3
39.1
4
553
催化剂b
12.0
71.6
(备注)甲醇选择性:转化的CO2中生成甲醇的百分比。下列说法不正确的是
A.相同温度下,在该时刻催化剂b对CO2转化成CH3OH有较高的选择性
B.其他条件不变,升高温度反应①中CO2转化为CH3OH平衡转化率增大
C.其他条件不变,增大反应体系压强反应②中平衡常数不变
D.反应①在无催化剂、有催化剂a和有 催化剂b三种情况下能量示意图如下:
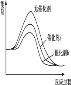
难度: 中等查看答案及解析
-
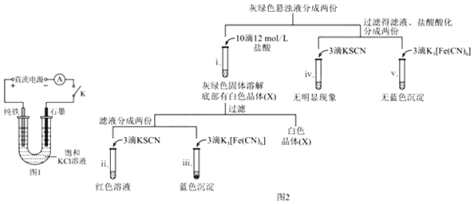
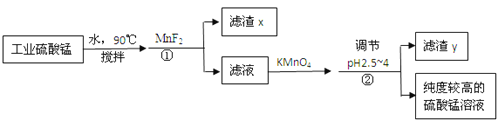
实验小组进行如下实验:
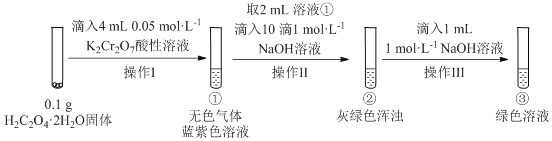
已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。下列关于该实验的结论或叙述不正确的是
A.①中生成蓝紫色溶液说明K2Cr2O7在反应中表现了氧化性
B.操作II中仅发生反应:Cr3++3OH-═Cr(OH)3↓
C.将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
D.若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
难度: 中等查看答案及解析
-
某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:配制50 mL 0.001 mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1 mol/L HCl溶液、1滴1 mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如下图所示。
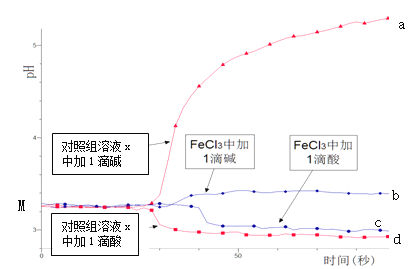
下列说法不正确的是
A.依据M点对应的pH,说明Fe3+发生了水解反应
B.对照组溶液x的组成可能是0.003 mol/L KCl
C.依据曲线c和d说明Fe3+水解平衡发生了移动
D.通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
难度: 中等查看答案及解析
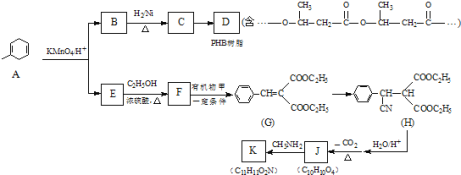
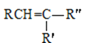
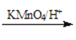 RCOOH+
RCOOH+