-
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物的碱性:X>Z
D.XR2、WR2两种化合物中R的化合价相同
难度: 中等查看答案及解析
-
化学与人类生活、社会可持续发展密切相关。下列说法不正确的是( )
A.采用纳米TiO2光触媒技术将装修材料中释放的HCHO转化为无害物质
B.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用
C.减少对化石燃料的依赖,有效降低PM2.5对环境的污染
D.目前汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.甲酸甲酯的实验式:CH2O B.丙烯醛的结构简式:CH2CHCHO
C.氮气分子的电子式:
D.H2CO3的电离方程式:H2CO3⇌2H++
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使pH试纸变蓝的溶液中:
、Na+、Cl-、ClO-
B.1.0 mol·L-1的HNO3溶液中:K+、[Ag(NH3)2]+、Cl-、
C.
=1的溶液中:Fe2+、
、Al3+、I-
D.0.1 mol·L-1的NH4HCO3溶液中:K+、Na+、
、Cl-
难度: 中等查看答案及解析
-
下列有关物质的性质与应用不对应的是( )
A.福尔马林能使蛋白质变性,可用于浸泡标本 B.油脂在碱性条件下易水解,可用于制作肥皂
C.NH3分解生成N2和H2吸收热量,液氨可用作制冷剂 D.ClO2具有强氧化性,可用于自来水的杀菌消毒
难度: 简单查看答案及解析
-
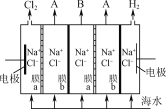
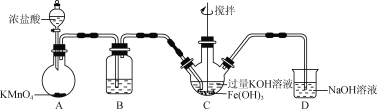
用下列实验装置进行相应的实验,能达到实验目的的是( )
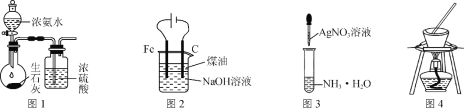
A.用图1装置制取干燥的氨气 B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置配制银氨溶液 D.用图4装置从食盐水中提取NaCl
难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.植物油含不饱和脂肪酸酯,能使Br2的CCl4溶液褪色
B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中
C.SO2通入到紫色石蕊试液中,溶液先变红后褪色
D.除去Mg(OH)2浊液中的Ca(OH)2,可加入足量MgCl2溶液充分搅拌后过滤
难度: 简单查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.MnO2与浓盐酸混合加热:MnO2+4H++4Cl-
MnCl2+ Cl2↑+2H2O
B.氢氧化钡溶液中加入硫酸铵:Ba2++OH-+
+
===BaSO4↓+NH3·H2O
C.FeSO4溶液中加入盐酸酸化的H2O2:Fe2++H2O2+2H+===Fe3++2H2O
D.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
+Al3++2
+2Ba2++4OH-===2BaSO4↓+Al(OH)3↓+NH3·H2O
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
① C
CO2
CO
CO2
② Fe
Fe2O3
Fe2(SO4)3
③SO2
NH4HSO3
(NH4)2SO4
④AlCl3
Al
NaAlO2
⑤CuSO4(aq)
Cu(OH)2
Cu2O
A.①②③ B.①③⑤ C.②③⑤ D.③④⑤
难度: 简单查看答案及解析
-
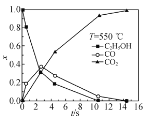
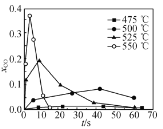
下列图示与对应的叙述相符的是( )
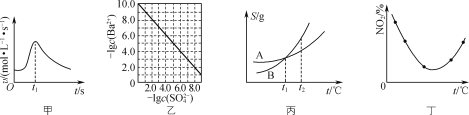
A.图甲表示镁条与盐酸反应的化学反应速率随反应时间变化的曲线,说明t1时刻溶液的温度最高
B.图乙表示室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(
)的关系曲线,说明溶液中c(
)越大c(Ba2+)越小
C.图丙表示A、B两物质的溶解度随温度变化情况,将t1 ℃时A、B的饱和溶液分别升温至t2 ℃时,溶质的质量分数w(B)>w(A)
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)⇌N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)常温下不能自发进行,说明ΔH<0
B.为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解
C.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度
D.对于N2(g)+3H2(g)⇌2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应速率增大、逆反应速率减小,平衡正向移动
难度: 中等查看答案及解析
-
Sorbicillin(简称化合物X)是生产青霉素时的一个副产品,其结构简式如下图所示。下列有关化合物X的说法不正确的是( )
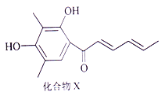
A.分子中所有碳原子可能处于同一平面
B.1 mol化合物X可以与2 mol Na2CO3反应
C.化合物X可以发生加成、取代、氧化反应
D.化合物X与H2完全加成,每个产物分子中含有4个手性碳原子
难度: 简单查看答案及解析
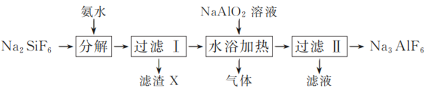
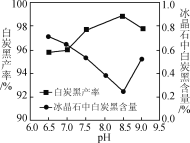
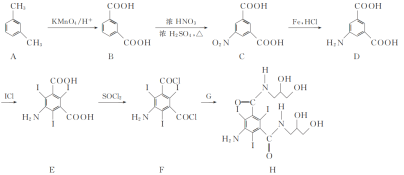
 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)_________。
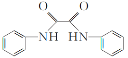
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)_________。