-
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
在抗击“2020新型冠状病毒”的过程中,口罩、防护服、消毒用品及疫苗投入使用。下列有关说法不正确的是( )
A.84消毒液和酒精均可杀灭新型冠状病毒,两者的消毒原理不同
B.新型冠状病毒疫苗一般应冷藏存放,其目的是避免蛋白质变性
C.聚丙烯和聚四氟乙烯为生产防护服的主要原料,两者均属于有机高分子材料
D.真丝织品和棉纺织品可代替熔喷无纺布生产防护口罩,两者均可防止病毒渗透
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.7g乙烯和丙烯混合气体中的氢原子数为NA
B.7.8g Na2O2与足量水充分反应转移的电子数目为0.2NA
C.1L 1mol·L−1的乙酸溶液中含H+的数量为NA
D.标准状况下,2.24L乙醇完全燃烧产生CO2分子的数目为NA
难度: 中等查看答案及解析
-
豆油被加热到185℃时会产生如图所示的物质。下列关于该物质的说法不正确的是( )
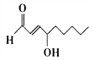
A.该有机物的分子式为
B.该有机物可以与H2发生加成反应
C.该有机物能使溴的四氯化碳溶液褪色 D.该有机物属于烃类化合物
难度: 中等查看答案及解析
-
下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,X和Z两元素的原子序数之和等于W元素的原子序数。下列说法正确的是( )
A.X、W分别与Y都能形成两种或两种以上的化合物,这些化合物都是酸性氧化物
B.X、Y、Z都能形成10电子的氢化物,其中Z的最简单氢化物沸点最高
C.X、Y、W与氢四种元素能组成离子化合物,该化合物一定能发生水解
D.X和W两元素的氧化物对应的水化物的酸性:X>W
难度: 中等查看答案及解析
-
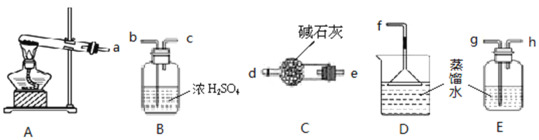
实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法不正确的是( )
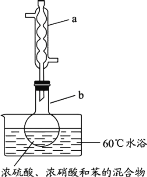
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.仪器a的作用是冷凝回流,提高原料的利用率
C.浓硫酸、浓硝酸和苯混合时,应先向浓硫酸中缓缓加入浓硝酸,待冷却至室温后,再将所得混合物加入苯中
D.反应完全后,可用蒸馏的方法分离苯和硝基苯
难度: 中等查看答案及解析
-
丙基(-C3H7))的二氯代物共有(不含立体异构)( )
A.9种 B.7种 C.8种 D.10种
难度: 中等查看答案及解析
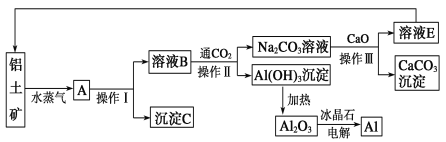
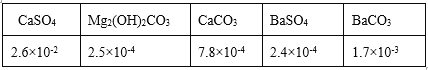
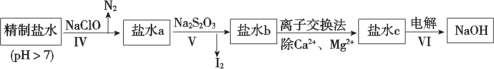
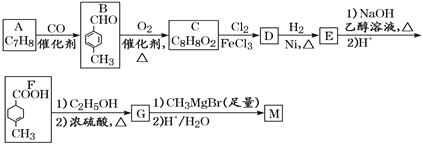
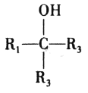
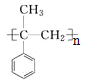 的合成路线___________。
的合成路线___________。