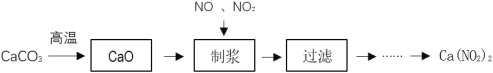
-
2020年是淮安市创建全国文明城市决胜之年。下列做法不应提倡的是( )
A.拒绝露天烧烤,合理健康饮食
B.秸秆就地焚烧,增强土壤肥效
C.推广电动汽车,践行绿色交通
D.施行垃圾分类,有效节约资源
难度: 简单查看答案及解析
-
是常用于医学PET显像的一种核素,这里的“13”是指该原子的
A.质子数 B.电子数 C.中子数 D.质量数
难度: 中等查看答案及解析
-
下列变化属于化学变化的是( )
A.煤的干馏 B.石油分馏 C.氨气液化 D.矿石粉碎
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A.N2的电子式:
B.NaCl的电子式:
C.H2O的结构式:H-O-H
D.Cl-的结构示意图:
难度: 中等查看答案及解析
-
下列属于吸热反应是( )
A.煤炭燃烧 B.硫酸和氢氧化钠溶液反应
C.铁与盐酸反应 D.NH4Cl与Ba(OH)2·8H2O反应
难度: 中等查看答案及解析
-
在含有大量H+、Ba2+、Cl-的溶液中,还可能大量共存的离子是( )
A.Ag+ B.K+ C.
D.
难度: 简单查看答案及解析
-
下列常见物质的俗名与化学式相对应的是( )
A.胆矾——CuSO4·5H2O B.烧碱——Na2CO3
C.小苏打——Na2SO4 D.明矾——Al2(SO4)3
难度: 简单查看答案及解析
-
以下物质间转化不能通过一步反应实现的是( )
A.Fe→FeCl2 B.N2→NO2
C.SiO2→Na2SiO3 D.Cl2→HCl
难度: 中等查看答案及解析
-
下列气体排放到空气中,会导致酸雨的是( )
A.NH3 B.CO2 C.N2 D.NO2
难度: 简单查看答案及解析
-
下列实验装置与操作都正确的是( )
A.
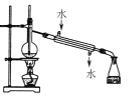 蒸馏海水 B.
蒸馏海水 B.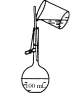 配制150mL稀盐酸
配制150mL稀盐酸C.
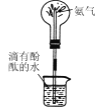 制造无色喷泉 D.
制造无色喷泉 D. 蒸发结晶
蒸发结晶难度: 简单查看答案及解析
-
下列物质中含有共价键的是( )
A.CaCl2 B.MgO C.K2O D.NaOH
难度: 简单查看答案及解析
-
下列物质属于离子化合物的是( )
A.H2 B.CO2 C.HCl D.NaBr
难度: 中等查看答案及解析
-
反应2NO+2CO
N2+2CO2可应用于汽车尾气的净化,下列关于该反应的说法正确的是( )
A.升高温度能减慢反应速率
B.使用恰当的催化剂能加快反应速率
C.减小NO浓度能加快反应速率
D.NO与CO反应时能100%转化为N2和CO2
难度: 简单查看答案及解析
-
碳原子成键的多样性、同分异构现象等是有机化合物种类繁多的原因。丁烷和2-甲基丙烷的结构式如图所示:
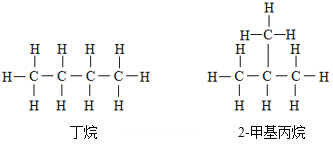
下列关于上述两种物质的说法正确的是( )
A.分子式不同 B.碳氢键(C-H)数目不同
C.互为同分异构体 D.物理性质、化学性质完全相同
难度: 简单查看答案及解析
-
铁片与稀硫酸反应制氢气,下列措施不能使氢气生成速率加大的是( )
A.加热 B.用铁粉代替铁片
C.滴加适量CuSO4溶液 D.用98%的浓硫酸代替稀硫酸
难度: 中等查看答案及解析
-
下列有关苯的说法错误的是( )
A.苯可以燃烧
B.苯分子的结构是平面正六边形
C.苯具有较强挥发性,有毒
D.苯的结构中含有碳碳双键,可以使溴水褪色
难度: 中等查看答案及解析
-
某饭店计划将燃料从煤气改为天然气,灶具应作相应调整,正确的方法是( )
A.空气和天然气进入量都减小
B.增大空气进入量或减小天然气进入量
C.空气和天然气进入量都增大
D.增大天然气进入量或减小空气进入量
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.铁与盐酸反应:2Fe+6H+=2Fe3++3H2↑
B.钠与水反应:Na+H2O=Na++OH-+H2↑
C.碳酸钙与醋酸反应:CO32-+2H+=CO2↑+H2O
D.铜与稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
难度: 中等查看答案及解析
-
某原电池装置如图所示。该电池工作时,下列说法正确的是( )
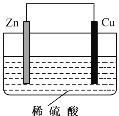
A.铜片作负极
B.Zn片发生还原反应
C.将化学能转化为电能
D.电子由铜片经导线流向锌片
难度: 简单查看答案及解析
-
下列有机反应方程式书写正确且为加成反应的是( )
A.CH4+Cl2
CH2Cl2+H2
B.CH2=CH2+Br2→CH3—CHBr2
C.CH2=CH2+H2O
CH3CH2OH
D.
+HNO3
+H2O
难度: 中等查看答案及解析
-
下列实验操作能达到目的的是( )
A.用碱石灰干燥氯气
B.用品红溶液鉴别CO2和SO2
C.用乙醇萃取碘水中的碘单质
D.用澄清石灰水检验碳酸钠溶液中是否含有碳酸氢钠
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是内层电子数的3倍,Y原子半径是短周期元素中最大的,Z与X属于同一主族。下列说法正确的是( )
A.由W、Y组成的化合物为共价化合物
B.Z的简单气态氢化物的热稳定性比X的强
C.原子半径:r(W)>r(Z)>r(Y)>r(X)
D.Y的最高价氧化物对应的水化物是一种强碱
难度: 中等查看答案及解析
-
根据下列实验操作和现象,所得结论正确的是( )
选项
操作
现象
结论
A
将两根打磨光亮的镁条分别插入硫酸铜溶液和硝酸银溶液
两根镁条上均有固体附着
金属的活动性顺序为Mg>Cu>Ag
B
将KSCN溶液滴入盛有无色溶液的试管中
溶液变为血红色
溶液中含有Fe3+
C
将铝片插入盛有浓硫酸的试管中
无明显现象
铝与浓硫酸不反应
D
将混有乙烯的甲烷气体通入到酸性KMnO4溶液中
紫红色溶液褪色
甲烷与酸性KMnO4溶液发生了反应
A.A B.B C.C D.D
难度: 中等查看答案及解析