-
通过下列实验操作和实验现象,得出的结论正确的是
实验操作
实验现象
结论
A
将丙烯通入碘水中
碘水褪色并分层
丙烯与碘水发生了取代反应
B
向FeSO4溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
FeSO4溶液未变质
C
向滴有酚酞的NaOH溶液中通入SO2气体
溶液红色褪去
SO2具有漂白性
D
向2mL 0.1mol/L的NaCl溶液中滴加3滴相同浓度的AgNO3,然后再滴加3滴相同浓度的KI溶液
先产生白色沉淀,然后变为黄色沉淀
Ksp(AgI)<Ksp(AgCl)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学与生活紧密相关,下列描述正确的是
A.流感疫苗一般应冷藏存放,以避免蛋白质变性
B.乳酸(
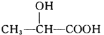 )通过加聚反应可制得可降解的聚乳酸塑料
)通过加聚反应可制得可降解的聚乳酸塑料C.“客从南溟来,遗我泉客珠。”“珍珠”的主要成分属于有机高分子化合物
D.水泥是由石灰石、石英砂、纯碱为原料烧制而成的
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.向FeCl3溶液中通人过量H2S:2Fe3++H2S=2Fe2++S↓+2H+
B.向NaHCO3溶液中加入少量澄清石灰水:Ca2++OH-+HCO3-=CaCO3↓+H2O
C.向NaClO溶液中通人少量SO2:SO2+ClO-+H2O=SO42-+Cl-+2H+
D.向FeI2溶液中通人等物质的量的Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
难度: 中等查看答案及解析
-
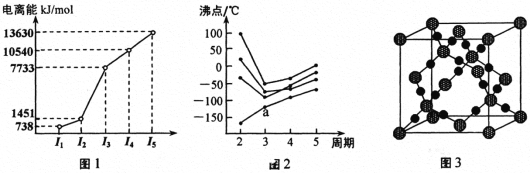
短周期主族元素M、X、Y、Z、W原子序数依次递增,在周期表中M的原子半径最小,X的次外层电子数是其电子总数的
,Y是地壳中含量最高的元素,M与W同主族。下列说法正确的是
A.Z的单质与水反应的化学方程式为:Z2+H2O=HZ+HZO
B.X和Z的简单氢化物的稳定性:X<Z
C.X、Y、Z均可与M形成18e-的分子
D.常温下W2XY3的水溶液加水稀释后,所有离子浓度均减小
难度: 中等查看答案及解析
-
实验室里模拟侯氏制碱原理制备少量小苏打,下列装置不正确的是
A.
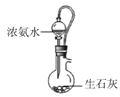 制备NH3
制备NH3B.
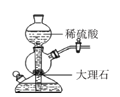 制备CO2
制备CO2C.
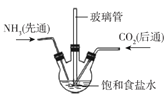 制备小苏打
制备小苏打D.
 分离小苏打
分离小苏打难度: 简单查看答案及解析
-
二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
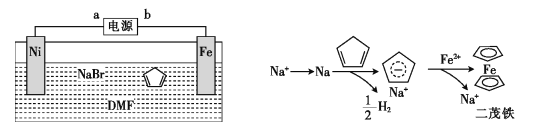
A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为
D.二茂铁制备过程中阴极的电极反应为
难度: 困难查看答案及解析
-
25℃时,用0.1mol•L-1NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=
]如图所示:
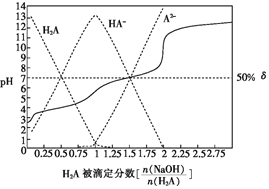
下列说法错误的是( )
A.用NaOH溶液滴定0.1mol•L-1NaHA溶液可用酚酞作指示剂
B.0.1mol•L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
C.0.1mol•L-1Na2A溶液中:c(Na+)>c(HA-)+2c(A2-)
D.H2A的Ka2=1×10-7
难度: 中等查看答案及解析
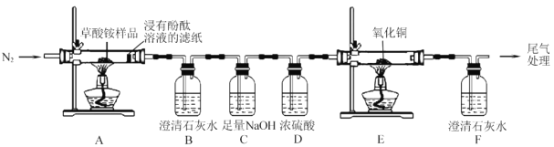
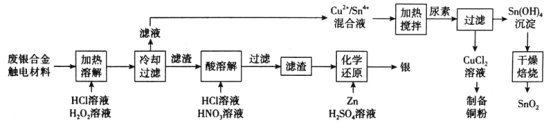
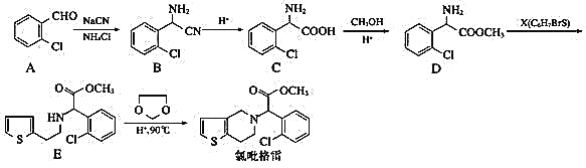
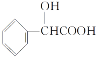 的合成路线(无机试剂任选)__。
的合成路线(无机试剂任选)__。