-
下列反应中,能够说明乙烯分子具有不饱和键的是( )
A.燃烧反应 B.取代反应
C.加成反应 D.化合反应
难度: 简单查看答案及解析
-
在元素周期表中金属与非金属的分界处,可以找到
A.合金材料 B.催化剂 C.农药 D.半导体材料
难度: 简单查看答案及解析
-
元素的性质随着元素原子序数的递增而呈周期性变化的原因是( )
A. 元素的金属性、非金属性呈周期性变化 B. 元素的原子半径呈周期性变化
C. 元素的化合价呈周期性变化 D. 元素原子的核外电子排布呈周期性变化
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.Li是最活泼金属,F是最活泼非金属
B.Mg(OH)2碱性比Ca(OH)2强
C.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
D.X2+的核外电子数目为18,则X在第四周期ⅡA族
难度: 中等查看答案及解析
-
已知氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ,下列关系式中正确的是( )
A.Q1+Q2>Q3 B.Q1+Q2<Q3 C.Q1+Q2<2Q3 D.Q1+Q2>2Q3
难度: 简单查看答案及解析
-
对10mL1mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )
A.降低温度 B.增加大理石的量
C.增加盐酸的浓度 D.加入5mLH2O
难度: 简单查看答案及解析
-
一定条件下能与苯发生化学反应的物质是( )
A. H2 B. 溴水 C. NaOH溶液 D. KMnO4酸性溶液
难度: 中等查看答案及解析
-
下列烷烃按沸点由高到低顺序排列正确的是( )
①正丁烷②异丁烷③正戊烷④异戊烷⑤新戊烷
A.①②③④⑤ B.⑤④③②① C.③①⑤④② D.③④⑤①②
难度: 中等查看答案及解析
-
下列元素中,不属于主族元素的是( )
A.磷 B.钙 C.铁 D.砹
难度: 简单查看答案及解析
-
下列物质的电子式书写正确的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
科学家预测,月球的土壤中吸附着数百万吨3He,100吨3He核聚变释放的能量相当于目前人类一年消耗的能量。下列说法正确的是( )
A.3He的最外层电子数为2,具有较强的金属性
B.3He位于周期表第二周期第ⅡA族
C.其原子核中质子数为2、中子数为1
D.核聚变是化学反应
难度: 简单查看答案及解析
-
关于化学键的下列叙述中,正确的是
A.离子化合物可能含共价键,共价化合物中一定不含离子键
B.共价化合物可能含离子键,离子化合物中只含离子键
C.构成单质分子的微粒一定含有共价键
D.在过氧化钠中,既存在离子键,又存在极性键
难度: 简单查看答案及解析
-
X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,下列的说法正确的是
A.X可能是第二周期非金属元素 B.X可能是第三周期金属元素
C.Y可能与X同主族 D.Y一定是金属元素
难度: 简单查看答案及解析
-
下列关于物质性质变化的比较,正确的是
A.碱性强弱:KOH>NaOH>Mg(OH)2 B.原子半径大小:Cl> Na>O
C.稳定性:HI>HBr>HCl>HF D.还原性强弱:Cl- > Br- > I-
难度: 简单查看答案及解析
-
如图所示,有关化学反应和能量变化的说法正确的是( )
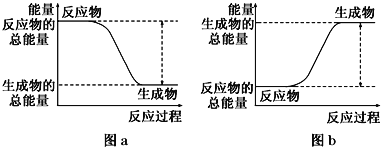
A. 图a表示的是吸热反应的能量变化
B. 图b中反应物比生成物稳定
C. 图a可以表示氯化铵固体与氢氧化钡晶体反应的能量变化
D. 图a不需要加热就能发生,图b一定需要加热才能发生
难度: 中等查看答案及解析
-
可逆反应H2(g)+I2(g)
2HI(g)达到平衡时的标志是( )
A.反应停止 B.n(H2):n(I2):n(HI)=1:1:2
C.H2、I2、HI的浓度相等 D.I2浓度不再改变
难度: 简单查看答案及解析
-
反应A+3B═2C+2D在四种不同的情况下的反应速率如下,最快的是( )
A.v(A)=0.15mol/(L•min) B.v(B)=0.6mol/(L•min)
C.v(c)=0.4mol/(L•min) D.v(D)=0.45mol/(L•min)
难度: 中等查看答案及解析
-
在一密闭容器中进行反应:2SO2+O2
2SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1 B.SO2为0.3 mol·L-1
C.SO3为0.4 mol·L-1 D.SO2、SO3均为0.1 mol·L-1
难度: 中等查看答案及解析
-
下列物质中属于有机物的是( )
①酒精 ②食盐 ③石墨 ④甲烷 ⑤红糖 ⑥水 ⑦一氧化碳 ⑧石灰石 ⑨脂肪 ⑩纤维素
A.①②④⑤⑨ B.①④⑤⑨⑩
C.①③④⑤⑦⑧⑨⑩ D.①④⑤⑥⑩
难度: 简单查看答案及解析
-
下列分子式肯定属于烷烃的是( )
A.C8H16 B.C5H8 C.C7H16 D.C7Hl4
难度: 简单查看答案及解析
-
下列叙述错误的是
A.通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应
B.甲烷是正四面体结构
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3,还是CCl4,都属于取代反应
D.甲烷的四种取代物常温下均为液体
难度: 简单查看答案及解析
-
山梨酸(CH3—CH=CH—CH=CH—COOH)是一种常用的食品防腐剂。下列关于山梨酸性质的叙述中,不正确的是( )
A.可与钠反应
B.可与碳酸钠溶液反应
C.可与溴水溶液发生取代反应
D.分子中含有两种官能团
难度: 简单查看答案及解析
-
除去乙烷气体中的少量乙烯的最好方法是( )
A.在催化剂存在下与氢气反应
B.通过盛有浓溴水的洗气瓶
C.通过高锰酸钾酸性溶液
D.依次通过KMnO4(H+)、NaOH溶液
难度: 中等查看答案及解析
-
丁烷(C4H10)一氯代物C4H9Cl的同分异构体数目共有
A.2种 B.3种
C.4种 D.5种
难度: 简单查看答案及解析
-
一定量的甲烷燃烧产物为CO、CO2和水蒸气,此混合气体重49.6g,当其缓慢通过无水CaCl2时,CaCl2增重25.2g,则原混合气体中CO的质量为( )
A.11.2g B.13.2g C.19.7g D.24.4g
难度: 中等查看答案及解析