-
化学与生活、科技及环境密切相关,下列说法正确的是
A.氢氧化铝可用于中和人体过多的胃酸
B.漂白粉在空气中久置变质,是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
C.“白墙黑瓦青石板,烟雨小巷油纸伞”,诗中伞骨架主要成分可用(C6H12O6)n表示
D.2020年3月9日,发射了北斗系统第五十四颗导航卫星,其计算机的芯片材料是一种有机高分子材料
难度: 简单查看答案及解析
-
常温下,将0.2mol/LKMnO4酸性溶液0.1L与一定量pH=3的草酸(HOOC—COOH)溶液混合,放出VL气体。NA表示阿伏加德罗常数的值,下列说法正确的是
A.该反应释放CO2分子数目为
NA
B.pH=3的草酸溶液含有H+数目为0.001NA
C.0.1molHOOC—COOH含共用电子对数目为0.9NA
D.当1molKMnO4被还原时,转移电子数为10NA
难度: 简单查看答案及解析
-
某有机物X的结构简式为
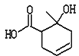 ,下列有关该有机物的说法正确的是
,下列有关该有机物的说法正确的是A.分子式为C8H10O3
B.既可以发生加成反应又可以发生取代反应
C.分子中所有碳原子共面
D.含有两种官能团
难度: 简单查看答案及解析
-
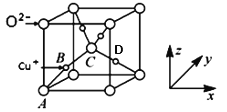
一种新型试剂(如图)可用于洗涤羊毛等,已知Z、Y、X、W原子序数依次增大,其中Z、Y、W为不同周期不同主族的短周期元素,W、Y、Z的最外层电子数之和等于X的最外层电子数,W和X对应的简单离子核外电子排布相同。下列叙述正确的是
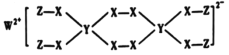
A.少量W单质保存在煤油中
B.W、X、Y对应原子半径顺序为:W>X>Y
C.该试剂中各元素均满足8电子稳定结构
D.Y的最高价氧化物对应水化物的化学式为H3YO3
难度: 中等查看答案及解析
-
一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4
ZnMn2O4.(0<x<1)。下列说法错误的是( )
A.充电时,阳极的电极反应式为Zn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.放电时,Zn2+向正极迁移
C.充放电过程中锌与锰的化合价都发生变化
D.放电时,每转移1mole-正极质量增加32.5g
难度: 中等查看答案及解析
-
分别进行下表所示实验,实验现象和结论均正确的是
选项
实验操作
现象
结论
A
测量熔融状态下NaHSO4的导电性
能导电
熔融状态下NaHSO4能电离出Na+、H+、
B
蘸有浓氨水的玻璃棒靠近X
有白烟产生
X可能为浓盐酸
C
将甲烷与氯气按体积比1:4混合于试管中光照
反应后混合气体能使润湿的石蕊试纸变红
生成的氯代甲烷具有酸性
D
将AlCl3溶液加热蒸干
得到白色固体
白色固体成分为纯净的AlCl3
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
25℃时,在20mL0.1mol·L-1一元弱酸HA溶液中滴加0.1mol·L-1NaOH溶液,溶液中1g
与pH关系如图所示。下列说法不正确的是
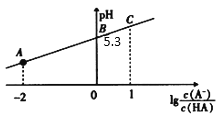
A.A点对应溶液中:c(A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,HA酸的电离常数的数量级为 10-6
C.对C点溶液加水稀释,
一定减小
D.当加入NaOH溶液体积为10 mL时,水的电离受到了抑制
难度: 中等查看答案及解析
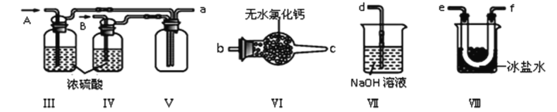
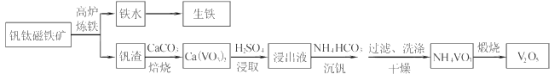
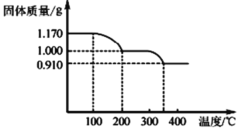
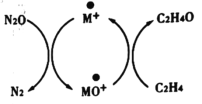
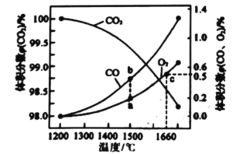
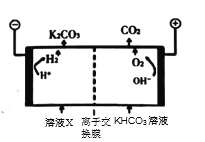
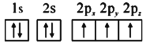 b.
b.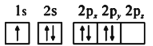
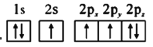 d.
d.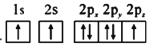
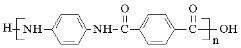 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: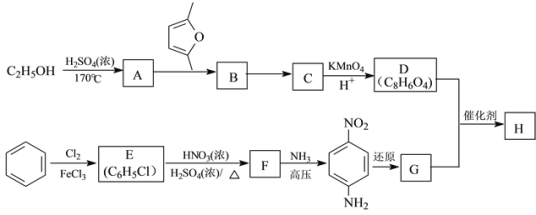
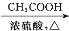 CH3COOC2H5)。
CH3COOC2H5)。