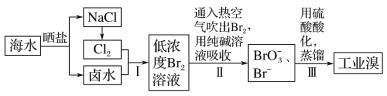
-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
下列关于物质分类的说法正确的是
A.金刚石、白磷都属于单质
B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质
D.葡萄糖、蛋白质都属于高分子化合物
难度: 简单查看答案及解析
-
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是( )
A. K B. Na C. Fe D. Al
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1mol FeI2与足量氯气反应时转移的电子数为2NA
B.2L 0.5mol•L﹣1硫酸钾溶液中阴离子所带电荷数为NA
C.1mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
难度: 困难查看答案及解析
-
向含有1 mol FeCl2的溶液中通入0.2 mol Cl2,再加入含0.1 mol X2O72—的酸性溶液,使溶液中Fe2+恰好全部被氧化,并使X2O72—被还原为Xn+,则n值为( )
A.2 B.3 C.4 D.5
难度: 简单查看答案及解析
-
下列物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作制冷剂
C.氢氟酸刻蚀玻璃 D.生石灰作干燥剂
难度: 简单查看答案及解析
-
下列实验能达到目的的是
A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液
B.将NH4Cl溶液蒸干制备NH4Cl固体
C.用萃取分液的方法除去酒精中的水
D.用可见光束照射以区别溶液和胶体
难度: 中等查看答案及解析
-
水溶液中能大量共存的一组离子是( )
A.Na+、Ca2+、Cl-、SO
B.Fe2+、H+、SO
、ClO-
C.Mg2+、NH
、Cl-、SO
D.K+、Fe3+、NO
、SCN-
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
B.6g二氧化硅中含有硅氧键的数目为0.2NA
C.标准状况下,11.2L苯中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
难度: 中等查看答案及解析
-
实验室中需要0.2mol/L的CuSO4溶液950mL, 配制时应选用的容量瓶的规格和称取胆矾(CuSO4·5H2O) 的质量分别是
A.950mL 30.4g B.950mL 47.5g C.1000mL 50.0g D.1000mL 32.0g
难度: 简单查看答案及解析
-
酸雨的形成是一种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如下:

下列有关说法错误的是( )
A. 光照能引发酸雨的形成
B. 所涉及的变化均为氧化还原反应
C. 污染空气能加快酸雨的形成
D. 优化能源结构能有效遏制酸雨污染
难度: 简单查看答案及解析
-
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多的是
A.FeO B.Fe2O3 C.FeSO4 D.Fe3O4
难度: 中等查看答案及解析
-
下列离子或分子在溶液中能大量共存,且满足相应要求的是( )
选项
离子或分子
要求
A
K+、SO
、Cl-、HS-
c(K+)=2c(SO
)
B
Fe3+、Na+、NO
、ClO-
溶液pH=1
C
NH
、Ba2+、NO
、CH3COOH
滴加NaOH溶液马上有气泡产生
D
Na+、Al3+、Cl-、SO
滴加氨水立即有沉淀产生
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
6.4g铜与过量的硝酸(8mol / L,60mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+为 n mol,此时溶液中所含NO3–物质的量为
A. 0.28mol B. 0.31mol
C. (n + 0.2) mol D. (n + 0.4) mol
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3
2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法不正确的是
A.4.6gNa 与含 0.1molHCl 的稀盐酸充分反应,转移电子数目为 0.2 NA
B.质量为 3.0g 的 15N2 和 C18O 混合物中含有中子数为 1.6NA
C.常温常压下,1.12L 的 CO2 和 SO2 混合气体中,含有氧原子的数目小于 0.1NA
D.在 1L相同浓度的硫酸钾和硫酸铁混合液中K+浓度为 0.2 mol·Lˉ1,则溶液中 SO42—的数目为0.3NA
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是( )
A.测0.1mol/L氨水的pH为11:NH3·H2O
NH4++OH-
B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、
、
B.c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、
、
C.0.1mol/LNH4HCO3溶液中:K+、Na+、
、Cl-
D.0.1mol/LFeCl3溶液中:Na+、
、S2-、
难度: 简单查看答案及解析
-
下列关于离子共存或离子反应的说法正确的是( )
A.pH=2的溶液中可能大量存在Na+、
、
B.某无色溶液中可能大量存在H+、Cl-、
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸与Ba(OH)2溶液的反应:H++
+Ba2++OH-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是( )
选项
实验操作
现象
结论
A
向苏打和小苏打溶液中分别加入盐酸
均冒气泡
两者均能与盐酸反应
B
向CuSO4溶液中滴加过量氨水
溶液澄清
Cu2+与NH3∙H2O能大量共存
C
将可调高度的铜丝伸入到稀HNO3中
溶液变蓝
Cu与稀HNO3发生置换反应
D
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置
下层溶液
显紫红色
还原性:Fe3+>I2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl-与SO42-的物质的量之比为 ( )

A.1:3 B.2:3
C.6:1 D.3:1
难度: 中等查看答案及解析
-
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为cmol/L,则下列关系中不正确的是( )
A.
B.
C.
D.c=
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,这些气体与 4.48 L O2(标准状况)混合后通入水中,气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入 400 mL NaOH溶液,此时 Cu2+恰好沉淀完全,所用 NaOH 溶液的浓度是( )
A.2 mol/L B.4 mol/L C.6 mol/L D.0.8 mol/L
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.明矾和Ba(OH)2溶液反应至硫酸根沉淀完全的离子方程式:Al3++
+Ba2++3OH-=Al(OH)3↓+BaSO4↓
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
D.向NaAlO2溶液通过量CO2制Al(OH)3:CO2+
+2H2O=Al(OH)3↓+
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下可溶性无机离子:
、
、
、
、
、
、
某同学收集了该地区的雾霾,经必要的预处理后的试样溶液,设计并完成了如下实验:
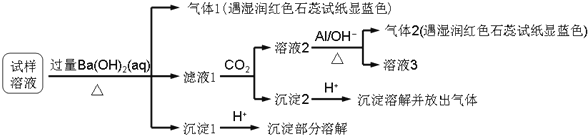
已知:
,根据以上的实验操作和现象,该同学得出的结论不正确的是
A.试样中肯定存在
、
、
和
B.试样中一定不含
C.试样中可能存在
、
D.该雾霾中可能存在
、
和
难度: 中等查看答案及解析