-
化学与人类生产、生活、科研密切相关。下列有关说法正确的是( )
A.白酒中混有少量的塑化剂(易溶于酒精),可以通过过滤的方法除去
B.蚕丝的主要成分是蛋白质
C.向燃煤中加入生石灰的目的是减少温室气体的排放
D.油脂在人体内水解为氨基酸,才能被人体吸收
难度: 简单查看答案及解析
-
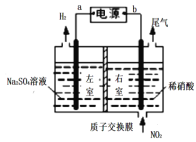
港珠澳大桥设计寿命达120年,对桥体钢构件采用的主要的防腐方法有:①钢梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不正确的是( )
A.钢铁在海水中的腐蚀主要为析氢腐蚀
B.方法①②③只能减缓钢铁腐蚀,未能完全消除
C.钢铁发生吸氧腐蚀时的负极反应式为:Fe-2e-Fe2+
D.①②防腐原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
下列热化学方程式中,正确的是( )
A.甲烷燃烧热为890.3 kJ•mol-1,热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=+890.3 kJ•molˉ1
B.稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为:H++OH-=H2O △H=-57.3 kJ•molˉ1
C.H2燃烧热为285.8kJ•molˉ1,燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ•molˉ1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=-38.6 kJ·mol-1
难度: 中等查看答案及解析
-
反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2=2HCl的反应速率v可表示为v=k[c(H2)]m[c(Cl2)]n,式中k为常数,m、n值可用下表中数据确定之。
c(H2)/mol·L-1
c(Cl2)/mol·L-1
v/mol·L-1·s-1
1.0
1.0
1.0 k
2.0
1.0
2.0 k
2.0
4.0
4.0 k
由此可推得,m、n值正确的是( )
A.m=1,n=2 B.m=1,n=
C.m=
,n=1 D.m=
,n=
难度: 中等查看答案及解析
-
下列说法中正确的是( )。
A.NaHCO3和NaHSO4都能促进水的电离
B.降低温度和加水稀释,都会使盐的水解平衡向逆反应方向移动
C.加热0.1mol/L Na2CO3溶液,CO32-的水解程度和溶液的pH均增大
D.水解平衡右移,盐的离子的水解程度一定增大
难度: 中等查看答案及解析
-
2019年6月6日,工信部正式向四大运营商颁发了5G商用牌照,揭示了我国5G元年的起点。通信用磷酸铁锂电池其有体积小、重量轻、高温性能突出、可高倍率充放电、绿色环保等众多优点。磷酸铁锂电池是以磷酸铁锂为正极材料的一种锂离子二次电池,放电时,正极反应式为M1-xFexPO4+e-+Li+=LiM1-xFexPO4,其原理如图所示,下列说法正确的是( )

A.放电时,电流由石墨电极流向磷酸铁锂电极
B.充电时,Li+移向磷酸铁锂电极
C.放电时,负极反应式为LiC6-e-=Li++6C
D.电池总反应为M1-xFexPO4+LiC6
LiM1-xFexPO4+6C
难度: 中等查看答案及解析
-
298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
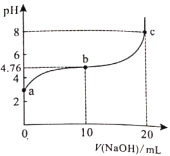
A.HA是弱酸 B.b点溶液中:
C.b、c之间一定存在
的点 D.a、b、c三点中,c点水的电离程度最大
难度: 中等查看答案及解析
-
中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键
H2O中H—O键
O2中O=O 键
H2中H—H键
H2O2中O—O键
H2O2中O—H键
键能kJ/mol
463
496
436
138
463
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应
难度: 中等查看答案及解析
-
常温下,向两只分别盛有50 mL0.100 mol/L盐酸的烧杯中各自匀速滴加50 mL蒸馏水、50 mL0.100 mol/L醋酸铵溶液,装置如图所示(夹持仪器等已略)。
已知:常温下,CH3COONH4溶液pH约为7。

下列说法正确的是( )
A.实验①滴加过程中溶液所有离子浓度都减小
B.实验②滴至pH=2时,溶液中c(Cl-)+c(CH3COO-)+c(OH-)=0.01 mol/L
C.实验②滴加过程中,溶液中均存在c(CH3COO-)<c(NH4+)
D.滴定结束后,①中水的电离程度比②中大
难度: 中等查看答案及解析
-
在密闭容器中加入CaSO4和CO,在一定温度下,发生反应:CaSO4(s)+CO(g)
CaO(s)+SO2(g)+CO2(g) ΔH=+218.4 kJ·mol-1

CO的反应速率随时间变化如图所示。下列说法正确的是( )
A.该反应是吸热反应,升高温度,正反应速率增大,逆反应速率减小
B.CaO是固态,不能用CaO表示反应的快慢
C.图示中t1时改变的条件可能是减小c(CO),同时增大c(SO2)
D.图示中t1时改变的条件可能是增大压强
难度: 简单查看答案及解析