-
化学与生产、生活息息相关。下列说法不正确的是
A.还原铁粉可以作食品袋内的抗氧化剂
B.抗病毒疫苗冷藏储运的目的是避免蛋白质变性
C.墨子号量子卫星使用的太阳能电池,其主要成分为硅
D.医用口罩使用的无纺布主要原料为聚丙烯树脂,属于天然有机高分子材料
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,9.5g羟基(—18OH)中所含中子数为5NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.2molFeBr2与足量氯气反应时,转移的电子数为6NA
D.甲烷燃料电池的正极消耗22.4LO2(标准状况下),电路中通过的电子数为4NA
难度: 简单查看答案及解析
-
下列实验方案中,可以达到实验目的的是
选项
实验操作与现象
目的或结论
A
用pH试纸分别测定相同温度和相同浓度的CH3COONa溶液和NaClO溶液的pH
验证酸性:CH3COOH>HClO
B
在一定条件下,向混有少量乙烯的乙烷中通入氢气
除去乙烷中的乙烯
C
向盛有少量Mg(OH)2固体的试管中加入适量NH4Cl浓溶液,充分振荡,白色固体溶解
与Mg(OH)2溶解出的OH-结合,导致Mg(OH)2溶解
D
向NaI、NaCl混合稀溶液中滴加少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgI)<Ksp(AgCl)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z、Q原子序数依次增大,X、Q同主族,W的简单氢化物可用作制冷剂,X是地壳中含量最多的元素,Y的原子半径是所有短周期主族元素中最大的,五种元素的最外层电子数之和为21。下列说法正确的是
A.简单离子半径:X<Y<Z<Q
B.最高价氧化物对应水化物的碱性:Y<Z
C.X的简单氢化物的热稳定性比W的强
D.工业上冶炼Y、Z的单质均是电解其熔融的氯化物
难度: 简单查看答案及解析
-
如图是一种最新研制的聚合物锂电池,a极为含有Li、Co、Ni、Mn、O等元素组成的混盐,电解质为一种能传导Li+的高分子复合材料,b极为镶嵌金属锂的石墨烯材料,反应原理为:LixC6+Li3-xNiCoMnO6
C6+Li3NiCoMnO6。下列说法正确的是
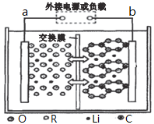
A.充电时,电池的a极反应为Li3NiCoMnO6—xe-=xLi++Li3-xNiCoMnO6
B.放电时,b极的电势高于a极
C.交换膜应为阴离子交换膜
D.充电时,若转移的电子数为6.02×1023个,则b极区会减少1 mol Li+
难度: 中等查看答案及解析
-
分子式为C4H7O2Cl,能与NaHCO3溶液反应产生气体的有机物共有(不含立体异构)
A.6种 B.5种 C.4种 D.3种
难度: 简单查看答案及解析
-
常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
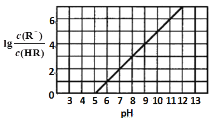
A.0.1mol·L-1HR溶液的pH为5
B.当pH=6时,水电离出的氢离子浓度为1.0×10-6
C.当通入0.1 mol NH3时,c(
)>c(R-)>c(H+)>c(OH-)
D.当 pH=7时,c(
)=c(R-)
难度: 中等查看答案及解析
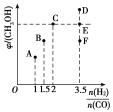
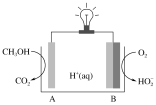
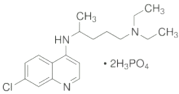
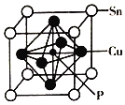


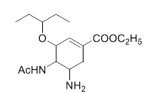
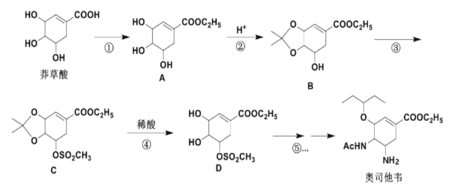
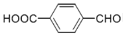 的合成路线____________。
的合成路线____________。