-
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
下列关于离子共存或离子反应的说法正确的是( )
A.某无色溶液中可能大量存在 H+、Cl-、MnO4-
B.pH=2 的溶液中可能大量存在 Na+、NH4+、SiO32-
C.Fe2+与 H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸与 Ba(OH)2 溶液的反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.增加c(CO),平衡向正向移动,反应的平衡常数增大
B.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C.第二阶段,Ni(CO)4分解率较低
D.该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:H2O>NH3>SiH4
B.氢元素与其他元素可形成共价化合物或离子化合物
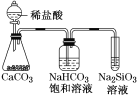
C.如图所示实验可证明元素的非金属性:Cl>C>Si
D.用中文“
”(ào)命名的第118号元素在周期表中位于第七周期0族
难度: 中等查看答案及解析
-
给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.粗硅
SiCl4
Si
B.Mg(OH)2
MgCl2(aq)
Mg
C.Fe2O3
FeCl3(aq)
无水FeCl3
D.AgNO3(aq)
[Ag(NH3)2]OH(aq)
Ag
难度: 中等查看答案及解析
-
合成导电高分子材料PPV的反应:
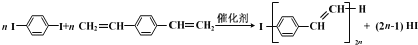
下列说法中正确的是( )
A.合成PPV的反应为加聚反应
B.PPV与聚苯乙烯具有相同的重复结构单元
C.
和苯乙烯互为同系物
D.通过质谱法测定PPV的平均相对分子质量,可得其聚合度
难度: 简单查看答案及解析

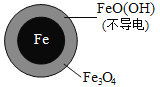
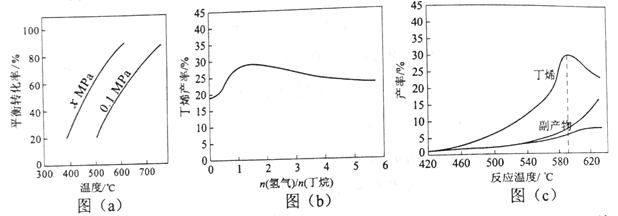
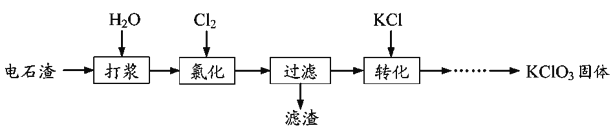
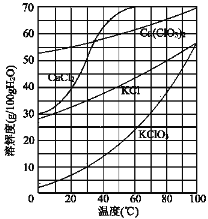
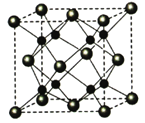
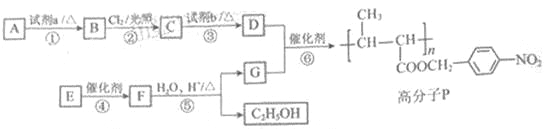
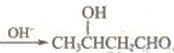 。
。