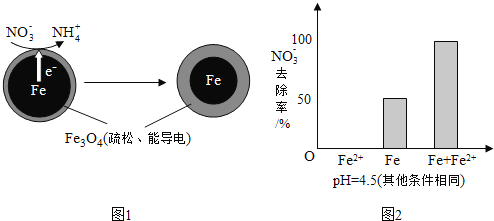
-
下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A. Ba(OH)2•8H2O与NH4Cl反应 B. 灼热的碳与高温水蒸气的反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
难度: 简单查看答案及解析
-
a,b,c,d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族数相同;d与a同族。下列叙述正确的是( )
A. 4种元素中b的金属性最强 B. 原子半径:d>c>b>a
C. c的氧化物的水化物是强碱 D. d单质的氧化性比a单质的氧化性强
难度: 中等查看答案及解析
-
下列关于元素金属性和非金属性强弱比较的说法不正确的是
A.将大理石加入稀盐酸中,能产生CO2气体,说明Cl的非金属性强于C
B.Si与H2化合所需温度远高于S与H2化合的温度,说明S的非金属性强于硅
C.Na与冷水能发生反应,而Mg与冷水反应缓慢,说明Na的金属性强于Mg
D.石灰乳能溶于盐酸,Be(OH)2与盐酸和NaOH都能反应,说明Ca的金属性强于Be
难度: 简单查看答案及解析
-
下列关于化学观或化学研究方法的叙述中,错误的是( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 在元素周期表的金属和非金属分界线附近寻找半导体材料
D. 根据元素周期律,由HClO4可以类推出氟元素的最高价氧化物的水化物为HFO4
难度: 中等查看答案及解析
-
2007年9月,美国科学家宣称发现了普通盐水在无线电波照射下可燃烧,这很可能是21世纪人类最伟大的发现之一,有望解决用水作人类能源的重大问题.无线电频率可以降低盐水中所含元素之间的“结合力”,释放出氢原子,若点火,氢原子就会在该种频率下持续燃烧.上述中“结合力”实质是( )
A.分子间作用力 B.氢键 C.非极性共价键 D.极性共价键
难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为: Na2S2O3+ H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
在恒温、恒容的密闭容器中进行反应A(g)+B(g)=C(g),若反应物A浓度从2mol·L-1降到0.8mol·L-1需20s,则反应物A的浓度由0.8mol·L-1降到0.2mol·L-1所需的反应时间( )
A.等于10s B.大于10s C.小于10s D.无法判断
难度: 简单查看答案及解析
-
使用下列装置给液体升温时,将化学能转化为热能的是
A.
 B.
B. 
C.
 D.
D. 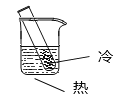
难度: 简单查看答案及解析
-
下列措施可以提高燃料燃烧效率的是( )
①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入大大过量的空气
A.①③ B.①②③ C.①③④ D.全部
难度: 简单查看答案及解析
-
下列说法正确的是
A.
、
、
三种核素的化学性质都不相同
B.16O2、18O2彼此是同位素
C.14N、14C两种核素的中子数相同,质子数不同
D.白磷与红磷是磷元素的两种同素异形体
难度: 中等查看答案及解析
-
下列说法正确的是
A. 共价化合物中可能含有离子键
B. 离子化合物中只含有离子键
C. 区别离子化合物和共价化合物的方法是看其水溶液是否能够导电
D. 离子化合物熔融状态能电离出自由移动的离子,而共价化合物熔融状态不能电离出自由移动的离子
难度: 困难查看答案及解析
-
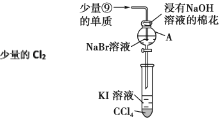
现将下列物质分别装入有水的锥形瓶里(见下图),立即塞紧带 U 形管的塞子, 发现 U 形管内滴有红墨水的水面如图所示状态,判断加入的物质不可能是( )
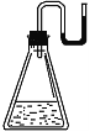
A.NaOH 固体 B.浓硫酸 C.
晶体 D.CaO固体
难度: 简单查看答案及解析
-
随着碱金属、卤素原子半径的增大,下列递变规律正确的是
A.碱金属和卤素单质的熔沸点都逐渐降低
B.碱金属和卤素单质的密度都依次变大
C.卤素的气态氢化物稳定性逐渐增强
D.碱金属单质还原性逐渐增强
难度: 简单查看答案及解析
-
2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A.In是第五周期第ⅢA族元素
B.11549In的中子数与电子数的差值为17
C.原子半径:In>Al
D.碱性:In(OH)3>RbOH
难度: 中等查看答案及解析
-
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆 开)1mol 化学键时释放(或吸收)的能量。已知白磷和
的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P—P:198,P—O:360,O=O:498,则对于反应
表述正确的是 ( )
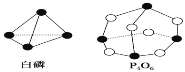
A.放出1638 kJ 的热量 B.吸收1638 kJ 的热量
C.放出126 kJ 的热量 D.吸收126 kJ 的热量
难度: 简单查看答案及解析
-
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为( )
①v(A)=0.15mol·L-1·s-1
②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1
④v(D)=0.45mol·L-1·s-1
该反应进行的快慢顺序为( )
A.②>④>③>① B.④>②=③>①
C.②=③>①>④ D.②>③=④>①
难度: 简单查看答案及解析
-
反应A+B→C((放热)分两步进行:①A+B→X(吸热)②X→C(放热),下列示意图中能正确表示总反应过程中能量进变化的是( )
A.
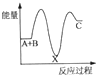 B.
B. C.
C.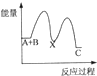 D.
D.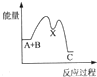
难度: 简单查看答案及解析
-
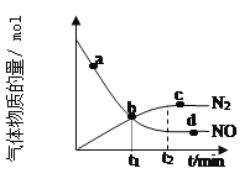
将过量的两份锌粉 a、b分别加入盛有等体积等浓度的稀硫酸中,同时向加入锌粉 a的稀硫酸中再加入少量
溶液,图中产生
的体积 V(L)与时 间 t(min)的关系,其中正确的是( )
A.
B.
C.
D.
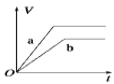
难度: 简单查看答案及解析
-
X、Y、Z三种短周期主族元素,原子半径的大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质在适当条件下可发生如图所示的变化,其中A为X、Y组成的双原子分子,B和C均为10电子分子。下列说法不正确的是( )
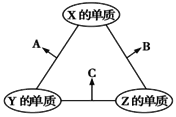
A.X元素位于第VIA族 B.A不能溶于B中
C.A是典型的酸性氧化物 D.B的沸点高于C的沸点
难度: 简单查看答案及解析
-
美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与12C是同位素
难度: 简单查看答案及解析
-
已知R2-的核内有n个中子,R原子的质量数为M,则mg R2-中含有电子的物质的量为
A.
mol B.
mol C.
mol D.
mol
难度: 简单查看答案及解析
-
镁—次氯酸盐电池的工作原理如图,该电池反应为:Mg+ClO-+H2O=Mg(OH)2+Cl-。下列有关说法正确的是( )
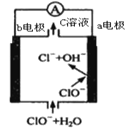
A.电池工作时,正极a附近的pH将不断增大
B.电池工作时,c溶液中的溶质是MgCl2
C.负极反应式:ClO-+2e-+H2O=Cl-+2OH-
D.a电极发生还原反应,每转移0.2mol电子,理论上生成0.2molCl-
难度: 中等查看答案及解析
-
下列有关元素周期表的结构叙述正确的是
A.元素周期表有七个横行,代表七个周期;有18个纵行,代表18个族
B.元素周期表中同周期ⅡA、ⅣA元素的原子序数之差可能为2、12、26
C.元素周期表中包含元素数目最多的是第一列
D.元素周期表中某些元素不可能既位于同一周期,又位于同一族
难度: 中等查看答案及解析
-
如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是( )
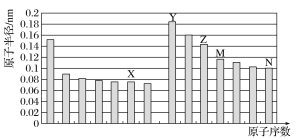
A.Z、N两种元素形成的化合物熔融状态下可以导电
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
难度: 中等查看答案及解析
-
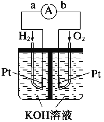
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。①a、b相连时,a为负极;②c、d相连时,电流方向为由d到c;③a、c相连时,a极质量减轻;④b、d相连时,b上有大量气泡产生。则四种金属的活动性强弱顺序为( )
A.
B.
C.
D.
难度: 中等查看答案及解析