-
下列不属于水解反应的是
A.NH4+ + H2O
NH3·H2O + H+ B.MgCl2 + 2H2O
Mg(OH)2+ 2HCl
C.HCO3―+ H2O
CO32- + H3O+ D.ClO- + H2O
HClO +OH-
难度: 中等查看答案及解析
-
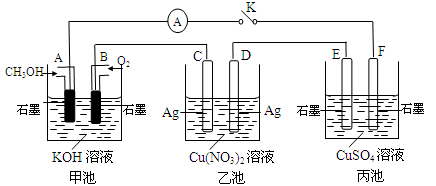
下列有关实验装置进行的相应实验,能达到实验目的的是
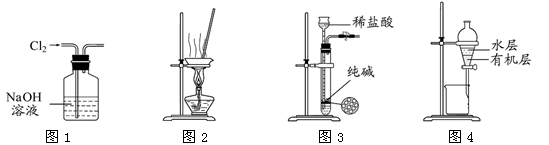
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
设阿伏加德罗常数的值为NA,则下列说法中正确的是
A.加热条件下,1mol Cl2与足量Fe粉充分反应,转移的电子数为3NA
B.1 L 1 mol·L-1的Na2CO3溶液中含有NA个CO32-
C.常温常压下,2.8g N2和2.8g CO所含电子数均为1.4NA
D.标准状况下,11.2L H2O中含有的原子数为1.5NA
难度: 中等查看答案及解析
-
某学生的实验报告所列出的下列数据中合理的是
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL滴定管做中和滴定时,消耗某浓度的碱溶液21.70mL
难度: 简单查看答案及解析
-
下列热化学方程式中的反应热下划线处表示燃烧热的是
A.NH3(g)+O2(g)
NO(g)+H2O(g)ΔH= —a kJ·mol-1
B.C6H12O6(s)+6O2(g)
6CO2(g)+6H2O(l)ΔH= —b kJ·mol-1
C.2CO(g)+O2(g)
2CO2(g)ΔH= —c kJ·mol-1
D.CH3CH2OH(l)+O2(g)
CH3CHO(l)+H2O(l)ΔH= —d kJ·mol-1
难度: 中等查看答案及解析
-
下列说法不正确的是
A.ΔH>0、ΔS>0的反应在任何温度下都不能自发进行
B.反应NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g)ΔH=+185.57 kJ·mol-1 之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向
C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据
D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率
难度: 中等查看答案及解析
-
下列表示化学反应的离子方程式,其中正确的是
A.NaAlO2溶液中滴加过量盐酸:AlO2-+H2O+H+= AI(OH)3
B.NH4HSO3溶液与足量浓NaOH溶液共热:NH4++HSO3-+2OH-
NH3↑+SO32-+2H2O
C.明矾溶于水产生Al(OH)3胶体: Al3++3H2O
Al(OH)3↓+3H+
D.FeCl3溶液与Cu反应: Fe3+ + Cu = Fe2+ + Cu2+
难度: 中等查看答案及解析
-
下列操作中,能使电离平衡H2O
H++OH-向右移动且溶液呈酸性的是
A.向水中加入NaHSO4溶液
B.向水中加入Al2(SO4)3溶液
C.向水中加入Na2CO3溶液
D.将水加热到100 ℃,使pH=6
难度: 中等查看答案及解析
-
可逆反应aA(s)+bB(g)
cC(g)+dD(g),反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是
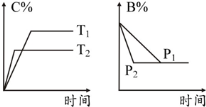
A.T1>T2
B.正反应为放热反应
C.P1>P2
D.a+b=c+d
难度: 中等查看答案及解析
-
已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl- 、Br- 和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl- 、Br- 、CrO42- B.CrO42-、Br- 、Cl-
C.Br- 、Cl- 、CrO42- D.Br- 、CrO42-、Cl-
难度: 困难查看答案及解析
-
常温下,某无色溶液能与铝反应放出氢气,该溶液中一定能大量存在的离子组是
A.Na+、K+、MnO4-、SO42- B.Mg2+、NH4+、SO42-、Cl-
C.Na+、Cl-、K+、SO42- D.Na+、K+、CO32-、NO3-
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH
溶液,其充、放电过程按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2,
有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2-e—+ OH—== NiOOH + H2O
B.充电过程中镉元素被氧化
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH— 向正极移动
难度: 困难查看答案及解析
-
下图表示反应N2(g)+3H2(g)
2NH3(g) △H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是

A.氨气的体积分数最高的一段时间为t5~t6
B.t2~t3和t3~t4时间段氨气的体积分数相等
C.t1时刻改变的条件是降低温度
D.t4~t5时间段平衡向正反应方向移动
难度: 困难查看答案及解析
-
25 ℃时,浓度均为为0.1 mol/L的HA溶液和BOH溶液,pH分别是1和11,下列说法正确的
A.BOH溶于水,其电离方程式是BOH
B+ + OH-
B.若将一定量的上述溶液混合后pH = 7,则c(A- )= c(B+)
C.在0.1 mol/L BA溶液中,c(B+)> c(A- )> c(OH- )> c(H+)
D.若将0.1 mol/L BOH溶液稀释至0.001 mol/L,则溶液的pH = 9
难度: 困难查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析
-
已知强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH- (aq)
H2O(l)
ΔH= —57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:
①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应。其焓变ΔH1、ΔH2、ΔH3的关系是
A.ΔH1>ΔH3>ΔH2 B.ΔH1<ΔH3<ΔH2
C.ΔH1=ΔH3>ΔH2 D.ΔH1>ΔH2>ΔH3
难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法不正确的是
A.钢铁在弱碱性条件下发生电化学腐蚀的正极反应是:O2+2H2O+4e-===4OH-
B.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用
难度: 中等查看答案及解析
-
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。已知: pM=-lgc(M),pc(CO32-)=-lgc(CO32-)。下列说法正确的是
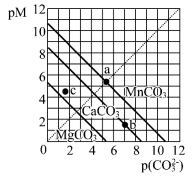
A.MgCO3、CaCO3、MnCO3 的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)> c(CO32-)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D.c点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-)
难度: 困难查看答案及解析