-
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是( )
A.10℃20mL3mol/L的盐酸溶液 B.20℃30mL2mol/L的盐酸溶液
C.20℃20mL2mol/L的盐酸溶液 D.20℃10mL4mol/L的盐酸溶液
难度: 简单查看答案及解析
-
下列有关元素周期表中元素性质的叙述正确的是
A. 同主族元素从上到下,非金属性逐渐增强
B. 元素的最高正化合价均等于它所在的族序数
C. 同周期的元素的原子半径越小,越难失去电子
D. 元素的非金属性越强,它的最高价氧化物对应的水化物的氧化性越强
难度: 中等查看答案及解析
-
下列过程中,共价键被破坏的是
A. 碘升华 B. 溴蒸气被木炭吸附 C. 酒精溶于水 D. HCl气体溶于水
难度: 简单查看答案及解析
-
一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池的组成正确的是( )
A
B
C
D
正极
Zn
Ag
Cu
Cu
负极
Cu
Cu
Zn
Zn
电解质溶液
CuCl2
H2SO4
CuSO4
FeCl3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知反应:X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因为该反应为放热反应,故不必加热反应就可以发生
难度: 简单查看答案及解析
-
下列各组物质中,互为同位素的是( )
A.D和T
B.H2O和H2O2 C.
和
D.O3和O2
难度: 简单查看答案及解析
-
下列物质中, 既含离子键、又含非极性共价键的是
A. NaOH B. Na2O2 C. NH4Cl D. CaCl2
难度: 中等查看答案及解析
-
在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.NH
、Cu2+、H+、NO
B.K+、Na+、Cl-、NO
C.Fe3+、Na+、CO
、SO
D.Ba2+、Fe2+、NO
、OH-
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.32g O2所含的原子数目为NA
B.标准状况下,11.2L H2O中含有的原子数目为1.5 NA
C.2L 0.3mol/L的K2SO4溶液中K+离子的物质的量浓度为1.2mol/L
D.常温下,05 NA个氯气分子的物质的量是0.5mol
难度: 简单查看答案及解析
-
下列微粒中与NH4+具有相同质子数和电子数的是( )
A.H3O+ B.H2O C.Ne D.OH-
难度: 简单查看答案及解析
-
下列表示物质或微粒的化学用语正确的是( )
A.HF的电子式为
B.质子数为35,中子数为45的溴原子:
C.Na2O2的电子式为:
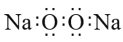
D.氯原子的结构示意图为:
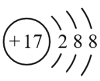
难度: 中等查看答案及解析
-
有A、B、C、D四种短周期元素,其简单离子A+、B2+、C-、D2-的电子层结构相同.则下列比较中正确的是( )
A.原子序数:A>B>C>D B.离子半径:A+>B2+>C->D2-
C.氢化物稳定性:H2D>HC D.金属性:A>B
难度: 困难查看答案及解析
-
在不同条件下,分别测得反应2SO2(g)+O2(g)⇌2SO3(g)的速率如下,其中化学反应速率最快的是( )
A.v(SO2)=4 mol·L-1·min-1
B.v(O2)=2 mol·L-1·min-1
C.v(SO3)=0.15 mol·L-1·s-1
D.v(SO2)=0.1 mol·L-1·s-1
难度: 简单查看答案及解析
-
下列各组物质均既有离子键又有共价键的是( )
A.KOH、H2SO4、NH4Cl B.CaO、Na2CO3、NH4HCO3
C.K2O2、NaOH、K2SO4 D.HClO、Al2O3、MgCl2
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W、R的化合价与原子序数的关系如下图所示.下列说法不正确的是( )
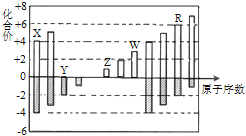
A.X、Y都存在同素异形现象
B.工业上常用W的氧化物为原料制取单质W
C.Z和Y形成的化合物中只存在离子键
D.常温下单质W不能溶于R的最高价氧化物对应水化物的浓溶液
难度: 中等查看答案及解析
-
下列说法正确的( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.离子化合物中只能含离子键
D.只有非金属原子间才能形成共价键
难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的( )
A.CaCO3(s) B.KNO3溶液
C.Na2SO4溶液 D.CuSO4(s)
难度: 中等查看答案及解析
-
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子构成HmX分子。在a g HmX中所含质子的物质的量是( )
A.
(A-N+m) mol B.
(A-N) mol
C.
(A-N) mol D.
(A-N+m) mol
难度: 简单查看答案及解析
-
实验室用贝壳与稀盐酸反应制备并收集CO2气体,下列装置中合理的是( )
A.
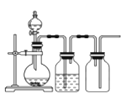 B.
B.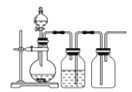 C.
C.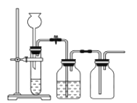 D.
D.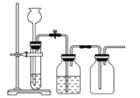
难度: 中等查看答案及解析
-
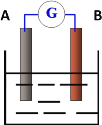
如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
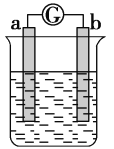
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液可为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
难度: 简单查看答案及解析