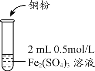
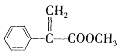-
化学与生活密切相关。下列叙述错误的是( )
A.医用防护口罩中使用的聚丙烯熔喷布,其生产原料来自石油裂解
B.核酸检测是确认病毒类型的有效手段,核酸是高分子化合物
C.韩愈的诗句“榆荚只能随柳絮,等闲撩乱走空园”中的柳絮富含糖类
D.北斗卫星导航专用ASIC硬件结合国产应用处理器打造出一颗真正意义的“中国芯”,该“中国芯”的主要成分为SiO2
难度: 简单查看答案及解析
-
用化学用语表示2Na + 2H2O=2NaOH + H2↑中的相关微粒,其中正确的是
A.中子数为10的氧原子:
O B.NaOH的电子式:
C.Na+的结构示意图:
 D.H2O的比例模型:
D.H2O的比例模型:难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A.常温下,10.6gC8H10和C4H10O3的混合物中氢原子数为NA
B.标准状况下,22.4LC2H4和CH3OCH3的混合气体完全燃烧转移的电子数目为12NA
C.只含有BaSO4[Ksp(BaSO4)=1.0×10-10]的悬浊液中,离子总数是2.0×10-5NA
D.室温下,pH=11,体积为1L的NaAlO2溶液中,发生电离的水分子数为1.0×10-3NA
难度: 中等查看答案及解析
-
白屈菜有止痛、止咳等功效,从其中提取的白屈菜酸的结构简式如图所示。下列有关白屈菜酸的说法中不正确的是( )
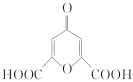
A.白屈菜酸的同分异构体中可能含有芳香族化合物
B.所有碳原子可以共面
C.1mol白屈菜酸完全燃烧需要O2的物质的量为4mol
D.能通过加聚反应形成高分子物质
难度: 中等查看答案及解析
-
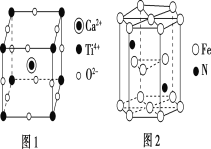
W、X、Y和Z为原子序数依次增大的四种短周期元素。X是短周期原子半径最大的元素,Y的最高化合价与最低价相加为0,Z是同周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如图所示。下列叙述正确的是
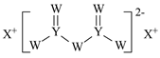
A.X单质的熔点高于Y单质
B.气态氢化物稳定性:Y<Z
C.Z的氧化物对应的水化物为强酸
D.X分别与W、Z形成的二元化合物溶于水显碱性
难度: 中等查看答案及解析
-
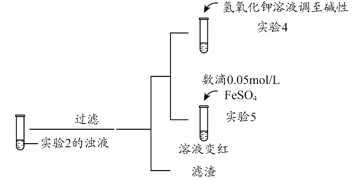
通过下列实验操作和实验现象,得出的结论正确的是( )
实验操作
实验现象
结论
A.将丙烯通入碘水中
碘水褪色并分层
丙烯与碘水发生了取代反应
B.向FeSO4溶液中滴加K3[Fe(CN)6]溶液
产生蓝色沉淀
FeSO4溶液未变质
C.向滴有酚酞的NaOH溶液中通入SO2气体
溶液红色褪去
SO2具有漂白性
D.向CuSO4溶液中加入KI溶液,再加入苯,振荡、静置
上层呈紫红色,下层有白色沉淀生成
铜离子可以氧化碘离子,白色沉淀可能为CuI
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某温度下,向一定体积0.1mol/L氨水中逐滴加入相同浓度的盐酸,溶液中pH与pOH的变化关系如图所示。下列说法错误的是( )
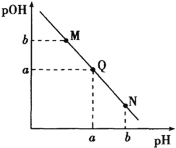
A.此温度下,水的离子积常数为1.0×10-2a
B.N点溶液加水稀释,
增大
C.M、Q、N三点所示的溶液中均存在:c(NH
)+c(H+)=c(OH-)+c(Cl-)
D.Q点消耗的盐酸的体积等于氨水的体积
难度: 中等查看答案及解析