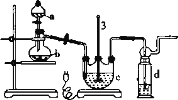
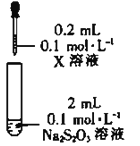
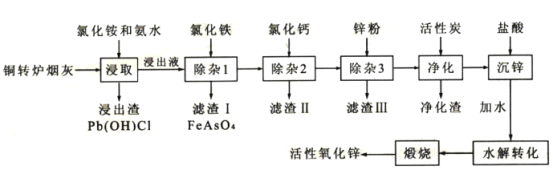
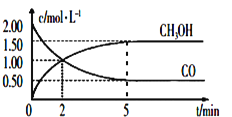
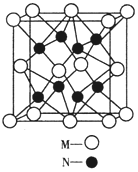
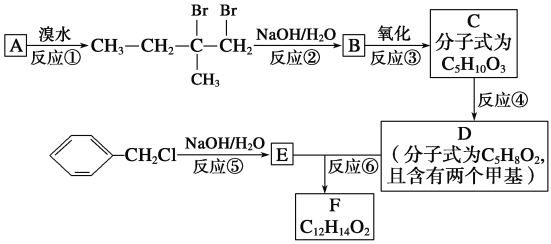
-
同周期的三种元素X、Y、Z,已知其最高价氧化物对应水化物的酸性强弱为HXO4>H2YO4>H3ZO4,则下列判断错误的是
A. 原子半径:X>Y>Z
B. 气态氢化物的稳定性HX>H2Y>ZH3
C. 电负性:X>Y>Z
D. 非金属性:X>Y>Z
难度: 中等查看答案及解析
-
下列关于化石燃料的加工说法正确的是 ( )
A. 石油裂化主要得到乙烯
B. 石油分馏是化学变化,可得到汽油、煤油
C. 煤干馏主要得到焦炭、煤焦油、粗氨水、粗苯和焦炉气
D. 煤制煤气是物理变化,是高效、清洁地利用煤的重要途径
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.0.1 mol C2H6O分子中含有C-H键数为0.5NA
B.2.24L乙烯通入足量溴水中充分反应,需反应Br2分子数为0.1NA
C.0.1mol乙醇与过量的乙酸在浓硫酸催化下充分反应后,生成乙酸乙酯分子数0.1NA
D.3.0 g甲醛(HCHO)和乙酸的混合物中含有的原子总数为0.4NA
难度: 中等查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A.S2Cl2的电子式为
B.固态时S2Cl2属于原子晶体
C.S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D.S2Cl2是含有极性键和非极性键的离子化合物
难度: 中等查看答案及解析
-
迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是 ( )
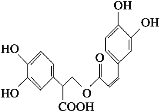
A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应、消去反应和酯化反应
D. 1 mol迷迭香酸最多能和6 mol NaOH发生反应
难度: 中等查看答案及解析
-
下列各组离子在指定环境中一定能大量共存的是( )
A.使pH试纸显蓝色的溶液中:Cu2+、NO
、Fe3+、SO
B.与铝粉反应放出氢气的无色溶液中:NO
、Al3+、Na+、SO
C.pH=0的溶液中:Al3+、NH
、Ca2+、ClO-
D.使红色石蕊试纸变蓝的溶液中:SO
、CO
、Na+、K+
难度: 简单查看答案及解析
-
某锂离子电池充电时的工作原理如图所示,LiCoO2中的Li+穿过聚内烯微孔薄膜向左迁移并嵌入石墨(C6表示)中。下列说法错误的是( )
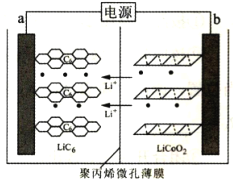
A.充电时,阳极电极反应式为LiCoO2-xe-=xLi++Lil-xCoO2
B.放电时,该电池将化学能转化为电能
C.放电时,b端为负极,发生氧化反应
D.电池总反应为LixC6+Lil-xCoO2
C6+LiCoO2
难度: 中等查看答案及解析
-
25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )

A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
难度: 中等查看答案及解析