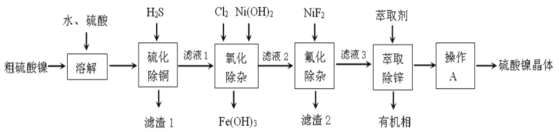
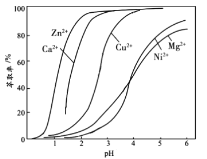
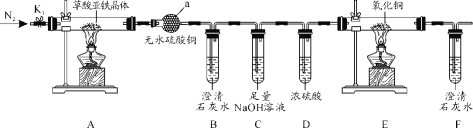
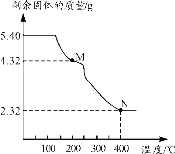
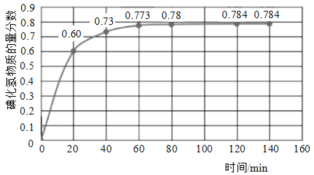
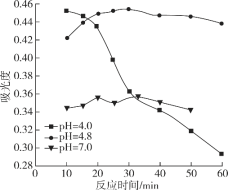
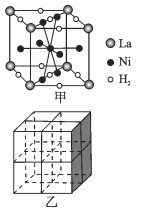
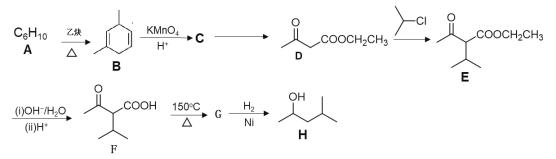
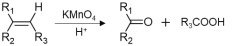
-
下列有关化学与生活说法正确的是( )
A.“歼-20”飞机上使用的碳纤维被誉为“新材料之王”,是我国打破其他国家技术垄断,自主研发和生产的一种新型有机高分子材料
B.硫酸亚铁与维生素C混用有利于铁元素吸收
C.我国海洋开发走向深蓝,大型舰船的底部常镶嵌锌块做正极,防止船底腐蚀
D.白砂糖的主要成分是蔗糖,蔗糖属于高分子化合物
难度: 简单查看答案及解析
-
2019年12月以来,我国武汉等地相继暴发了新冠肺炎,为此我国政府和相关部门采取了多项措施控制疫情。75%乙醇和84消毒液等均能有效灭活新冠病毒。84消毒液的主要成分是次氯酸钠。设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.74.5g次氯酸钠中含有的离子数目为2NA
B.1mol次氯酸钠与足量盐酸反应转移的电子数为2NA
C.50g34%H2O2溶液中含H-O键的数目为NA
D.利用氯气和氢氧化钠溶液反应制取0.1mol次氯酸钠需要消耗2.24L氯气
难度: 中等查看答案及解析
-
下列实验能达到预期目的的是( )
实验内容
实验目的
A
向1 mL 0.1mol/L NaOH溶液中加入2 mL 0.1mol/L CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热未出现红色沉淀
证明葡萄糖中含有醛基
B
向1 mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2
溶液,产生白色沉淀后,再滴加2滴0.1mol/L
FeCl3溶液,又生成红褐色沉淀
证明在相同温度下,Ksp[Mg(OH)2]>Ksp[Fe(OH)3]
C
测定同温度下相同浓度的碳酸钠和硫酸钠溶
液的pH,前者大于后者
证明碳元素非金属性弱于硫
D
向某溶液中滴加少量稀NaOH溶液,将湿润的红色石蕊
试纸置于试管口试纸不变蓝
证明溶液中无NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
科学家提出由 WO3 催化乙烯和 2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
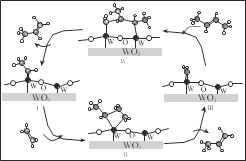
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是( )
A.Y的最高价氧化物对应水化物的酸性比W的强
B.W的气态氢化物比X的稳定
C.离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z)
D.XY2与ZY2中的化学键类型相同
难度: 中等查看答案及解析
-
最近,科学家成功研制出一种电源,该电源在消耗二氧化碳的同时,还可释放电能。电源电极为铝电极和多孔碳电极,电解质溶液为草酸盐溶液,放电过程中草酸盐浓度基本不变,电源示意图如图所示。下列有关该电源的说法正确的是
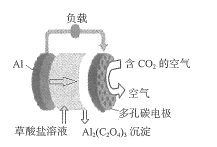
A.铝电极电势高于多孔碳电极
B.用该电源电解饱和食盐水,理论上,每消耗1mol二氧化碳可收集到标准状况下 11.2L 氢气
C.若生成0.5 mol 草酸铝,有3mol电子通过电解质溶液
D.正极的电极反应式为
难度: 中等查看答案及解析
-
类比pH的定义,对于稀溶液可以定义pC(X)=-lgc(X),pKa=-lgKa,常温下,某浓度H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
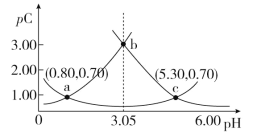
A.随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B.pH=4.50时,c(HA-)>c(A2-)=c(H2A)
C.b点时,
=104.50
D.pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
难度: 中等查看答案及解析