-
下列文物的材质属于合金的是

A.A B.B C.C D.D
难度: 简单查看答案及解析
-
糖类、油脂、蛋白质是人体必需的基本营养物质,下列说法不正确的是
A.向蔗糖酸性条件下水解后的溶液中直接加入新制 Cu(OH)2 悬浊液,检验其是否水解
B.油酸甘油酯与氢气反应可得到硬脂酸甘油酯,还可以在碱性条件下水解为油酸钠和甘油
C.氨基酸与酸可以反应生成盐,是因为分子结构中含有-NH2
D.向鸡蛋清溶液中加入 BaCl2 溶液,产生白色沉淀,过滤后向白色沉淀中加水,沉淀不溶解
难度: 简单查看答案及解析
-
下列玻璃仪器的洗涤方法正确且涉及氧化还原反应的是
A.附有银镜的试管用氨水清洗 B.附有油脂的烧杯用热纯碱溶液清洗
C.附有MnO2的烧瓶用热的浓盐酸清洗 D.附有碘的试管用酒精清洗
难度: 中等查看答案及解析
-
中科院电子学研究所的研究人员已经掌握了锶原子光钟研究的一系列关键技术,为显著提高卫星导航系统的定位精度奠定了基础。锶(元素符号 Sr)的原子序数为 38,下列说法中不正确的是
A.84Sr、86Sr、87Sr、88Sr 互为同位素
B.由 Sr 的原子序数可知,其在周期表中的位置是第五周期第 IIA 族
C.根据元素周期律可知,Sr(OH)2 的碱性强于 Ca(OH)2,弱于 Ba(OH)2
D.根据元素周期律可知,Sr 的还原性强于 Mg,因此可以从 MgCl2 溶液中置换出 Mg
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1 的溶液中:HCO
、SO
、K+、Cl-
B.遇酚酞变红的溶液中:NO
、Na+、、SiO
、K+
C.c(NO
) = 1 mol·L -1 的溶液中:H+、Fe2+、Cl-、NH
D.无色透明溶液中: K+、SO
、Na+、MnO
难度: 中等查看答案及解析
-
下列解释事实的化学用语正确的是
A.用饱和 Na2CO3 溶液浸泡锅炉水垢除去其中的 CaSO4:CO
+ CaSO4
CaCO3 + SO
B.用白醋和淀粉 KI 试纸检验加碘盐中的 KIO3:5I− + IO
+ 3H2O = 3I2 + 6OH-
C.碱性条件下,用 KClO 溶液与 Fe(OH)3 反应制备新型净水剂 K2FeO4: 3ClO− + 2Fe(OH)3 = 2FeO
+ 3Cl− + 4H+ + H2O
D.氯碱工业制备氯气:2Cl− + 2H+
Cl2↑+ H2↑
难度: 困难查看答案及解析
-
一定温度下,H2(g)与I2(g)反应生成HI(g),反应的能量变化如下图所示。下列说法不正确的是
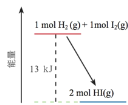
A.H2(g)+I2(g)=2HI(g) ΔH=-13kJ·mol−1
B.反应物的总能量比生成物的总能量高
C.H2(g)和I2(g)的总能量比HI(g)的能量高13kJ
D.断裂反应物中化学键吸收的总能量比形成生成物中化学键放出的总能量低
难度: 中等查看答案及解析
-
化合物 Y 能用于高性能光学树脂的合成,可由化合物 X 与 2-甲基丙烯酰氯在一定条件下反应制得:
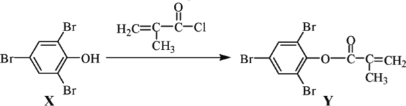
下列有关化合物 X、Y 的说法正确的是
A.X 分子中所有原子一定共平面 B.Y 分子存在顺反异构
C.可以用酸性 KMnO4 溶液鉴别 X 和 Y D.X→Y 的反应为取代反应
难度: 简单查看答案及解析
-
下列实验能够达到实验目的的是
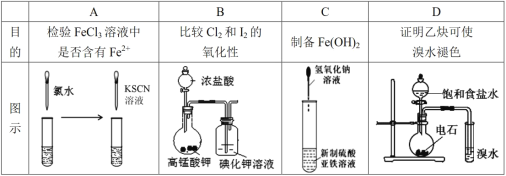
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:
MnO2+
Zn +(1+
)H2O+
ZnSO4
MnOOH+
ZnSO4[Zn(OH)2]3·xH2O
其电池结构如图1所示,图2是有机高聚物的结构片段。
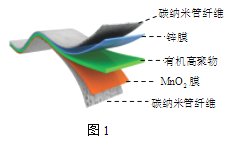
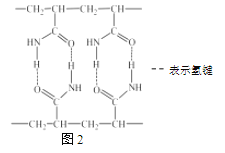
下列说法中,不正确的是
A. 碳纳米管具有导电性,可用作电极材料
B. 放电时,电池的正极反应为:MnO2+e−+H+==MnOOH
C. 充电时,Zn2+移向Zn膜
D. 合成有机高聚物的单体是:
难度: 中等查看答案及解析
-
根据下列图示所得出的结论不正确的是
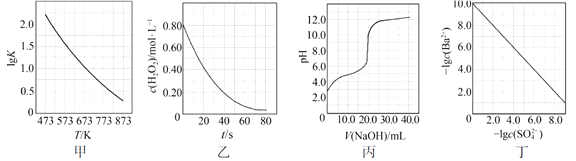
A.图甲是CO(g)+H2O(g)
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C.图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸
D.图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小
难度: 中等查看答案及解析
-
在大试管内将足量NaHCO3加热到 200℃,将产生的混合气体通入到盛有1.87 g Na2O和Na2O2的密闭容器中,待Na2O和Na2O2全部反应后,得到标准状况下224 mL O2;再将反应后密闭容器内的固体全部溶于水配成 100 mL 溶液。下列说法正确的是
A.Na2O和Na2O2 均为碱性氧化物
B.参加反应的NaHCO3物质的量为 0.04 mol
C.反应过程中总共转移 0.04 mol 电子
D.配成的 100 mL 溶液中 c(Na+) = 0.5 mol/L
难度: 困难查看答案及解析
-
在 3 个体积均为 2.0 L 的恒容密闭容器中,反应H2O(g) + C(s)
CO(g) + H2(g) ΔH > 0分别在一定温度下达到化学平衡状态。下列说法正确的是
容器
温度
(T1>T2)
起始时物质的量/mol
平衡时物质的量/mol
n(H2O)
n(C)
n(CO)
n(H2)
n(CO)
I
T1
0.5
1
0
0
0.25
II
T1
1
1
0
0
x
III
T2
0
0
0.5
0.5
y
A.当温度为 T1时,该反应的化学平衡常数值为 0.25
B.若 5min 后容器 I 中达到平衡,则 5min 内的平均反应速率:v(H2) = 0.05mol·L-1·min-1
C.达到平衡时,容器 II 中H2O的转化率比容器 I 中的小
D.达到平衡时,容器 III 中的 CO 的转化率小于 50%
难度: 困难查看答案及解析
-
在药物制剂中,抗氧剂与被保护的药物在与
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
、
和
是三种常用的抗氧剂。下列说法中,不正确的是
已知:
溶于水发生反应:
实验用品
实验操作和现象
①
溶液
②
溶液
③
溶液
实验1:溶液①使紫色石蕊溶液变蓝,溶液②使之变红。
实验2:溶液①与
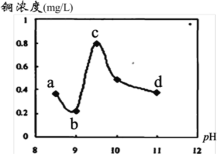
反应,保持体系中
浓度不变,不同pH条件下,
随反应时间变化如图所示。
实验3:调溶液①②③的pH相同,保持体系中
浓度不变,测得三者与
的反应速率相同。

A.
溶液显碱性,原因是:
B.
溶液中
的电离程度大于水解程度
C.实验2说明,
在
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同
难度: 中等查看答案及解析
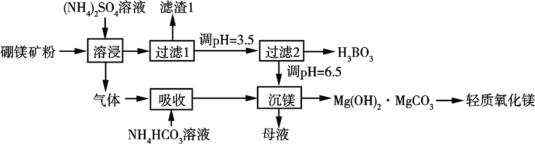

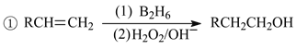
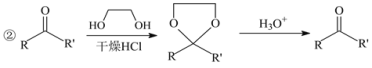

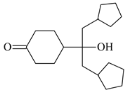 的合成路线(其他试剂任选)_______________________________________________。
的合成路线(其他试剂任选)_______________________________________________。