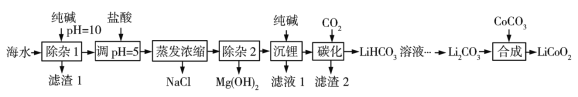
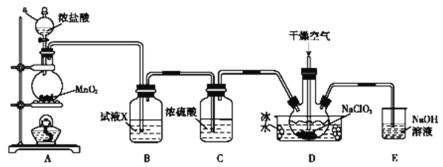
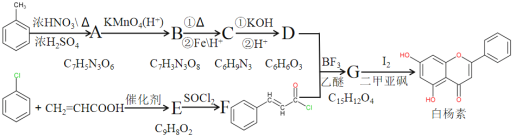
-
成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
选项
传统文化
化学角度解读
A
兰陵美酒郁金香,玉碗盛来琥珀光
“香”主要因为美酒含有酯类物质
B
“司南之杓(勺),投之于地,其柢(勺柄)指南”
司南中“杓”的材质为Fe2O3
C
三月打雷麦谷堆
在雷电作用下N2转化成能被作物吸收的氮元素
D
《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也
利用物理方法(焰色反应)可以检验钠盐和钾盐
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
金合欢醇广泛应用于多种香型的香精中,其结构简式如图所示。下列说法不正确的是( )
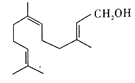
A.金合欢醇的同分异构体中不可能有芳香烃类
B.金合欢醇可发生加成反应、取代反应、氧化反应
C.金合欢醇分子的分子式为C15H26O
D.1 mol金合欢醇与足量Na反应生成0.5 mal氢气, 与足量NaHCO3溶液反应生成1 mol CO2
难度: 困难查看答案及解析
-
NA是阿伏加德罗常数的值。下列说法正确的是
A.0.5 mol N4(分子为正四面体结构)含共价键数目为2NA
B.锌与浓硫酸反应生成气体11.2 L(标准状况)时转移电子数目为NA
C.1 L 0.5 mol·L1 Na2S溶液中含阴离子数目小于0.5NA
D.14 g己烯和环己烷的混合物含氢原子数目为3NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A.Na与H2O反应:Na+H2O=Na++OH-+H2↑
B.向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++HCO
+OH-=CaCO3↓+H2O
C.向含0.2 mol FeI2的溶液中滴加含0.25 mol Cl2的氯水:2Fe2++8I-+5Cl2=2Fe3++4I2+10Cl-
D.电解MgCl2溶液:2H2O+2Cl-
2OH-+H2↑+Cl2↑
难度: 中等查看答案及解析
-
下列有关实验操作或叙述正确的是( )
A.配制浓硝酸和浓硫酸的混合液时,将浓硝酸缓慢注入浓硫酸,并搅拌
B.在硫酸亚铁溶液中滴加NaClO溶液可检验FeSO4是否变质
C.滴定终点时,滴定管的尖嘴可以接触锥形瓶内壁
D.用玻璃瓶保存NH4F、KOH、Na2SiO3等溶液时要使用软木塞
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最低负价等于X、Z的最低负价之和,Y的周期数是族序数的3倍,W的简单氢化物与X的简单氢化物化合形成的盐中既含离子键又含共价键。下列说法正确的是( )
A.Y与X形成化合物的水溶液呈碱性.
B.常压下,单质的沸点:W>Z
C.原子半径:W<X<Y<Z
D.W的氧化物的水化物的酸性比Z的弱
难度: 中等查看答案及解析
-
常温下,Ksp(MnS)=2.5×10-13,Ksp(FeS)=6.3×10-18。FeS和MnS在水中的沉淀溶解平衡曲线如图所示(X2+表示Fe2+或Mn2+),下列说法错误的是( )

A.曲线I表示MnS的沉淀溶解平衡曲线
B.升高温度,曲线Ⅱ上的c点可沿虚线平移至d点
C.常温下,反应MnS(s)+Fe2+(aq)
FeS(s)+Mn2+(aq)的平衡常数K≈4×104
D.向b点溶液中加入少量Na2S固体,溶液组成由b点沿工线向a点方向移动
难度: 中等查看答案及解析