-
科学防护对预防病毒感染非常重要,下列说法错误的是
A.冠状病毒粒子直径约60-220 nm,介于溶液和胶体粒子之间
B.制作防护服和口罩的无纺布是有机高分子材料
C.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
D.二氧化氯泡腾片可用于水处理
难度: 中等查看答案及解析
-
化合物c的制备原理如下:
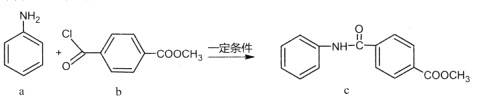
下列说法正确的是
A.该反应为加成反应 B.化合物a中所有原子一定共平面
C.化合物C的一氯代物种类为5种 D.化合物b、c均能与NaOH溶液反应
难度: 中等查看答案及解析
-
下列实验及现象不能得出相应结论的是
选项
实验
现象
结论
A
某溶液中滴加K3[(Fe(CN)6]溶液
产生蓝色沉淀
原溶液中有 Fe2+
B
将CO2依次通过 NaHSO3溶液、品红溶液
品红溶液不褪色
H2SO3的酸性强于比H2CO3
C
向 l mL 新制氢氧化铜悬浊液中滴加适量 10 %葡萄糖溶液,加热煮沸
产生砖红色沉淀
葡萄糖具有还原性
D
向 lmL0. l mol/L AgNO3溶液中滴加4~5 滴 0.l mol/L KI 溶液,再滴加几滴 0. 1mo l/L Na2S 溶液
先有黄色沉淀生成;后又有黑色沉淀
Ksp (AgI )> Ksp (Ag2S)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
W、X、Y、Z 均为短周期主族元素,X与Z同族,X核外电子总数等于Y最外层电子数,Y是短周期中非金属性最强的元素,W与Z的最高化合价之和为8, 且W原子半径小于Z。下列叙述正确的是
A.气态简单氢化物的稳定性:Z>X>W
B.W和Y可形成共价化合物WY3,且WY3中W、Y均满足最外层 8 电子稳定结构
C.常温下,0.l mol•L-1Z的最高价氧化物对应水合物水溶液的 pH >l
D.常温下,与W同族且相邻元素的单质能溶于X的最高价氧化物对应水化物的浓溶液。
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.电解饱和食盐水获取烧碱和氯气:
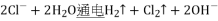
C.向氢氧化钡溶液中加入稀硫酸:
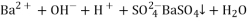
D.向碳酸氢铵溶液中加入足量石灰水:
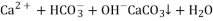
难度: 中等查看答案及解析
-
全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是
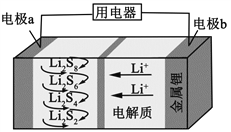
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e−=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中Li2S2的量越多
难度: 困难查看答案及解析
-
我国科学家开发设计一种天然气脱硫装置,利用如右图装置可实现:H2S+O2→H2O2 +S。已知甲池中有如下的转化:
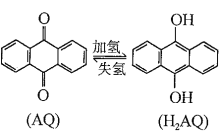
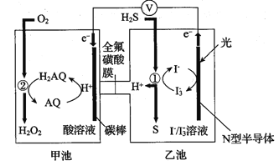
下列说法错误的是:
A. 该装置可将光能转化为电能和化学能
B. 该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池
C. 甲池碳棒上发生电极反应:AQ+2H+ +2e- =H2AQ
D. 乙池①处发生反应:H2S+I3- =3I-+S↓+2H+
难度: 中等查看答案及解析
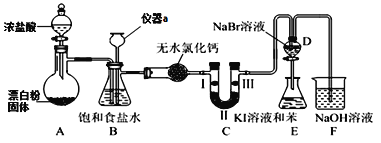
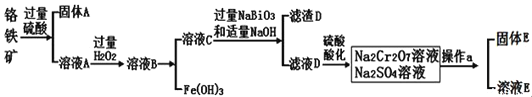
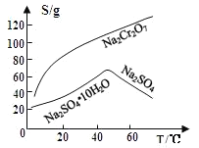

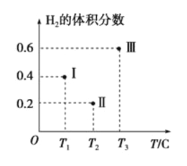
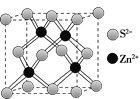
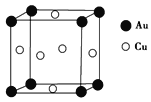
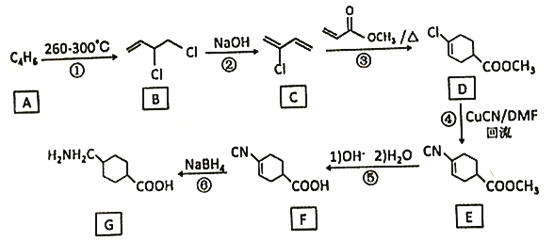
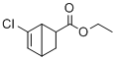 的合成路线:_______(无机试剂任性)
的合成路线:_______(无机试剂任性)