-
新中国成立70年来,我国在载人飞船、北斗卫星、高铁、5G技术等领域取得了举世瞩目的成就。它们均与化学有着密切联系。下列说法正确的是
A.截止2019年11月我国光缆线路总长超过三千万公里,光纤的主要成分是碳化硅
B.我国大力调整能源结构,大力发展核电、光电、风电、水电、火电等新能源
C.国庆阅兵中出现的直-20直升机使用了大量的新型材料,其中锂铝合金属于金属材料
D.我国的高铁运营里程世界第一,硅钢是铁轨的主要材料
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。如图表示N2O在Pt2O+表面与CO反应转化成无害气体的过程。下列说法正确的是
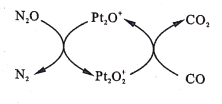
A.N2O转化成无害气体时的催化剂是Pt2O2+
B.每1mol Pt2O+转化为Pt2O2+得电子数为3NA
C.将生成的CO2通人含大量SiO32-、Na+、Cl-的溶液中,无明显现象
D.1g CO2 、N2O的混合气体中含有电子数为0.5NA
难度: 中等查看答案及解析
-
下列各组离子在溶液中可以大量共存,且加入或通入试剂X后,发生反应的离子方程式正确的是
选项
离子组
试剂X
发生反应的离子方程式
A
K+、Na+、
、
少量HCl
H2O+H++
=Al(OH)3↓
B
、Fe2+、Br-、
少量H2S
Fe2++H2S=FeS↓+2H+
C
ClO-、Na+、Ca2+、
少量CO2
CO2+Ca2++H2O+2ClO-=CaCO3↓+2HClO
D
I-、Cl-、Na+、
少量稀硝酸
6I-+2
+8H+=2NO↑+4H2O+3I2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
脱氢醋酸钠是FAO和WHO认可的一种安全型食品防霉、防腐保鲜剂,它是脱氢醋酸的钠盐。脱氢醋酸的一种制备方法如图,下列说法错误的是
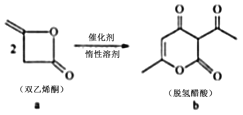
A.a分子中所有原子处于同一平面 B.a.b均能使酸性 KMnO4溶液褪色
C.a.b均能与 NaOH溶液发生反应 D.b与
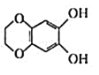 互为同分异构体
互为同分异构体难度: 简单查看答案及解析
-
下列有关实验现象和解释或结论都正确的是( )
选项
实验操作
现象
解释或结论
A
取硫酸催化淀粉水解的反应液,滴入少量新制
悬浊液并加热
有砖红色沉淀生成
葡萄糖具有还原性
B
溶液与
溶液混合
有白色絮状沉淀生成
二者水解相互促进生成氢氧化铝沉淀
C
将充满
和
混合气体的密闭玻璃球浸泡在热水中
红棕色变深
反应
的
D
向
饱和溶液中滴入足量浓氨水,并加热至刚好沸腾
得到红褐色透明液体
得到
胶体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下表是元素周期表短周期的一部分,这四种元素原子的最外层电子数之和为21。下列说法错误的是
A.最简单氢化物沸点:W >Z B.Y的最高价氧化物不能与碱反应
C.简单离子的半径:Y <X D.Y和Z形成的化合物的水溶液呈酸性
难度: 中等查看答案及解析
-
室温下,乙二胺(H2NCH2CH2NH2,用符号B表示)溶于水存在如下平衡:B + H2O⇌HB+ + OH-Kb1;HB+ + H2O⇌H2B2+ + OH-Kb2。其水溶液中的相关组分B、HB+、H2B2+的物质的量分数δ(X)随溶液pH的变化曲线如图所示[δ(X)=
]。下列说法正确的是
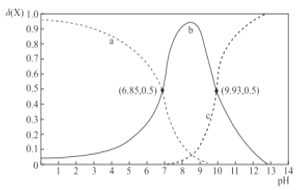
A.曲线b表示δ(H2B2+)随溶液pH的变化情况
B.等浓度的乙二胺的水溶液与盐酸等体积混合后,溶液呈酸性
C.等物质的量的[H2B]Cl2和[HB]Cl的混合溶液中,c(H2B2+)<c(HB+)
D.Kb1的数量级为10-4
难度: 中等查看答案及解析
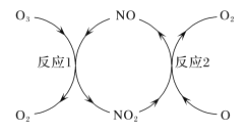
 ×100%
×100%
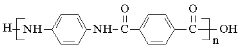 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下: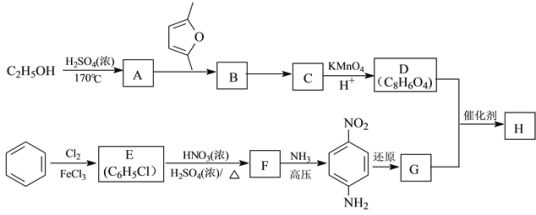
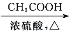 CH3COOC2H5)。
CH3COOC2H5)。