-
化学与生产、生活密切相关。下列叙述中不正确的是( )
A.将电器垃圾深埋处理可减少重金属对环境的危害
B.将少量二氧化硫添加到红酒中可起到杀菌和抗氧化作用
C.对化学燃料脱硫、脱氮可减少酸雨的形成
D.用CO2合成聚碳酸酯可降解塑料可实现碳的循环利用
难度: 简单查看答案及解析
-
84消毒液可用于新型冠状病毒的消杀,其主要成分为NaClO。NaClO在空气中可发生反应NaClO+CO2+H2O
NaHCO3+HClO。用化学用语表示的相关微粒,其中正确的是
A.中子数为10的氧原子:
B.Na+的结构示意图:
C.CO2的结构式:O=C=O
D.NaClO的电子式:
难度: 简单查看答案及解析
-
下列有关物质的性质与用途正确且具有对应关系的是( )
A.碳酸钠溶液显碱性,可用于治疗胃酸过多症
B.二氧化硅熔点高、硬度大,可用于制造光导纤维
C.浓硫酸有吸水性,可用于干燥二氧化硫和溴化氢气体
D.Fe3+有较强氧化性,可用FeCl3溶液腐蚀电路板上的铜
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.无色澄清的溶液:Na+、NH
、S2-、ClO-
B.能使石蕊变红的溶液:Fe2+、Na+、NO
、SO
C.水电离的c(H+)=1×10-13mol·L-1的溶液中:Ba2+、K+、HCO
、S2-
D.
=10-12的溶液中:Na+、NO
、AlO
、CO
难度: 中等查看答案及解析
-
用下列实验装置进行相应实验能达到实验目的的是( )

A.用甲装置从KI和I2的固体混合物中回收I2
B.用乙装置接收石油分馏实验中所得的馏分
C.用丙装置测量用MnO2和浓盐酸共热制得的Cl2体积
D.用丁装置准确量取一定体积的KMnO4标准溶液
难度: 简单查看答案及解析
-
下列有关化学反应的叙述正确的是( )
A.过氧化钠在空气中变色,发生了氧化还原反应
B.工业上可用氯气和澄清石灰水反应制漂白粉
C.硫在过量氧气中燃烧生成三氧化硫
D.过量的铜和浓硝酸反应时只生成一种气体
难度: 简单查看答案及解析
-
下列指定反应的离子方程式书写正确的是( )
A.将浓FeCl3溶液加入沸水中:Fe3++3H2O=Fe(OH)3↓+3H+
B.用氨水吸收足量的SO2气体:NH3·H2O+SO2=NH
+HSO
C.向NH4HSO4溶液中加入足量Ba(OH)2溶液:Ba2++OH-+H++SO
=BaSO4↓+H2O
D.用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+=2Fe3++3H2O
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层电子数是次外层的3倍,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是( )
A.原子半径:r(X)<r(Y)<r(Z)<r(W)
B.由X、Z两种元素组成的化合物一定没有共价键
C.W的最高价氧化物对应水化物为弱酸
D.Y的简单气态氢化物的沸点比W的强
难度: 简单查看答案及解析
-
乙炔在Pd表面选择加氢的反应机理如图所示。其中吸附在Pd表面上的物种用*标注。
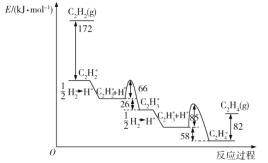
下列有关说法正确的是( )
A.该正反应历程中最大能垒(活化能)为85kJ·mol-1
B.吸附反应为吸热反应
C.Pd为固体催化剂,其表面积大小对催化效果无影响
D.C2H2*+H*→C2H3*只有化学键的形成过程
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.SO2
CaSO3
CaSO4
B.Fe3O4(s)
Fe(s)
Fe(NO3)3(aq)
C.MgO(s)
MgSO4(aq)
Mg(s)
D.Fe
FeSO4(aq)
Fe(OH)2
FeO
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.CH3Cl(g)+Cl2(g)
CH2Cl2(l)+HCl(g)能自发进行,则该反应的ΔH>0
B.室温下,稀释0.1mol·L-1NH4Cl溶液,溶液中
增大
C.向稀氨水中加入少量氯化铵固体,一水合氨的电离程度增大
D.向硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,向沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3)
难度: 困难查看答案及解析
-
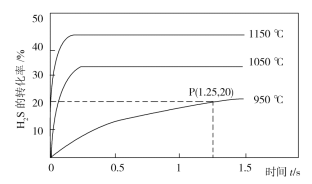
在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂已广泛使用。在UO2(NO3)2—HNO3—N2H4·HNO3体系下采用电解法制备四价铀,电解总反应为2UO
+N2H
+3H+
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
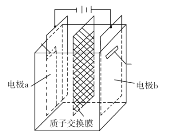
A.电解液中NO
的移动方向:a极→质子交换膜→b极
B.b极的电极反应式为UO
+2H2O+2e-=U4++4OH-
C.若转移4mole-,将有4molH+透过质子交换膜
D.当产生11.2mLN2时,同时生成U4+的质量为0.238g
难度: 中等查看答案及解析