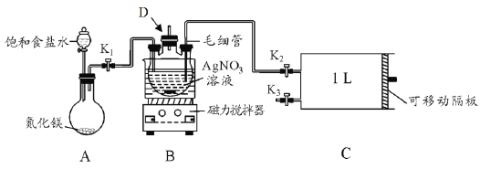
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1L0.lmol/L的Na2CO3溶液中含阴离子总数为0.1 NA个
B.0.1mol的2H35Cl分子的中子数是2NA
C.1mol Na2O2与足量CO2充分反应转移的电子数目为2NA
D.加热条件下,含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数小于0.1NA
难度: 中等查看答案及解析
-
短周期元素W、X、Y、Z的原子序数依次增大。W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同。下列说法错误的是( )
A. 单质的沸点:Z>W
B. 简单离子半径:X>W
C. 元素X与氧可形成既含离子键又含非极性共价键的化合物
D. X、Y、Z的最高价氧化物对应的水化物两两之间能相互反应
难度: 简单查看答案及解析
-
“中国名片”中航天、军事、天文等领域的发展受到世界瞩目,它们与化学有着密切的联系。下列说法不正确的是( )
A.“天宫二号”空间实验室的硅电池板将光能直接转换为电能
B.“蛟龙”号潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
C.“歼-20”飞机上大量使用的碳纤维是一种新型有机高分子材料
D.港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极保护法
难度: 简单查看答案及解析
-
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )
A.分子式为C7H10O5,属于芳香族化合物,易溶于水
B.分子中含有3种官能团,可以发生加成、氧化、取代等反应
C.在水溶液中,1mol莽草酸最多可电离出4molH+
D.1mol莽草酸与足量的NaHCO3溶液反应可放出4molCO2气体
难度: 简单查看答案及解析
-
研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO (慢):②FeO++CO=CO2+Fe+ (快)。下列说法正确的是
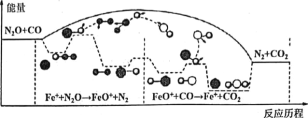
A. 反应①是氧化还原反应,反应②是非氧化还原反应
B. 两步反应均为放热反应,总反应的化学反应速率由反应②决定
C. Fe+使反应的活化能减小,FeO+是中间产物
D. 若转移lmol电子,则消耗II.2LN2O
难度: 中等查看答案及解析
-
用下列装置完成相关实验,合理的是( )

A.图①:验证H2CO3的酸性强于H2SiO3
B.图②:收集CO2或NH3
C.图③:分离Na2CO3溶液与CH3COOC2H5
D.图④:分离CH3CH2OH与CH3COOC2H5
难度: 中等查看答案及解析
-
25℃时,用0.1 mol·L-1NaOH溶液分别滴定20.00mL 0.1 mol·L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是
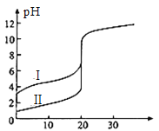
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等
C.V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)> c(Na+)> c(H+)> c(OH-)
D.V(NaOH)=20.00mL时,两溶液中c(CH3COO-)> c(Cl-)
难度: 中等查看答案及解析
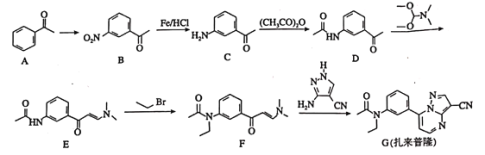
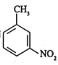 和乙醇制备
和乙醇制备 的合成路线(无机试剂任选)。________
的合成路线(无机试剂任选)。________