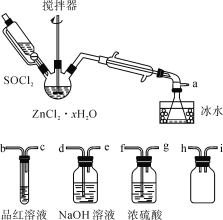
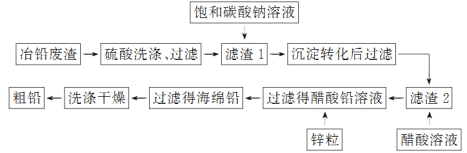
-
化学与生产、生活及环境密切相关,下列有关说法正确的是( )
A.中国古代利用明矾溶液的酸性清洗铜镜表面的铜锈
B.有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物
C.汽车尾气污染物中含有的氮氧化物是汽油不完全燃烧造成的
D.用于光缆通信的光导纤维和制作航天服的聚酯纤维都是新型无机非金属材料
难度: 简单查看答案及解析
-
X、Y、Z、R、W是5种短周期主族元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期,下列说法错误的是( )
A.原子半径:Z>R>W
B.气态氢化物稳定性:HnW>HmR
C.X2W6分子中各原子最外层电子均满足8电子结构
D.Y、Z、R三种元素组成的化合物水溶液一定显碱性
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值。下列叙述正确的是
A.46g有机物C2H6O中含有极性共价键的数目一定为7NA
B.密闭容器中1molH2与1molI2制备HI,增加2NA个H-I键
C.25℃,1LpH=13的Ba(OH)2溶液中OH-数为0.2NA
D.0.1molFe 在足量氧气中燃烧,转移电子数为4/15NA
难度: 中等查看答案及解析
-
根据下列实验操作及现象,能推出相应结论的是
实验操作及现象
结论
A
加热石蜡后生成的气体能使酸性高锰酸钾溶液褪色
加热石蜡产生的气体一定是乙烯
B
向饱和硼酸溶液中加少量NaHCO3粉末,无气泡冒出
酸性:碳酸>硼酸
C
向MgCl2溶液中滴加足量NaOH溶液,有白色沉淀生成,再滴加CuCl2溶液,又有蓝色沉淀生成
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
D
向淀粉溶液中加稀硫酸共热,冷却后再加入新制Cu(OH)2悬浊液,加热,无砖红色沉淀生成
淀粉没有发生水解
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
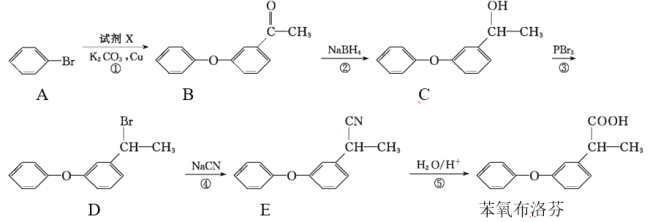
分子式均为C5H10O2的两种有机物的结构简式如右图所示:
下列说法正确的是
A. 二者都能使Br2的CCl4溶液褪色
B. ①②分子中所有原子均可能处于同一平面
C. 等质量的①和②分别与足量钠反应生成等质量的H2
D. 与其互为同分异构体的酯有8种(不考虑立体异构)
难度: 简单查看答案及解析
-
某温度时,将nmol·L-lCH3COOH溶液滴入10mL1.0mol·L-1NaOH溶液中,溶液pH和温度随加入CH3COOH溶液体积变化曲线如图所示,下列有关说法正确的是
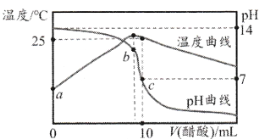
A. Kw:a>b B. 25℃时:K( CH3COOH)=1/(n-1) •10-7
C. n<1.0 D. 水的电离程度:c>b
难度: 困难查看答案及解析
-
某同学用下图实验装置验证通过改变浓度来实现反应,2Fe3++2I-=2Fe2++I2中Fe3+与Fe2+的相互转化。K 闭合时,电流表指针第一次发生偏转,当指针归零后,向左管滴油加0.01mol/L的AgNO3溶液,发现指针第二次偏转,方向相反。下列有关说法不正确的是( )
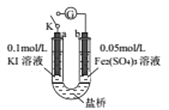
A. 指针第一次偏转时,b极反应式为Fe3++e-=Fe2+
B. 加入AgNO3后,a为正极
C. 当b极有0.001molFe3+被还原时,则通过盐桥的电子数为0.001NA
D. 第二次指针偏转的原因是:I-浓度减小,反应逆向进行
难度: 中等查看答案及解析