-
“分类”是一种思想方法,在化学发展中起到了重要的作用,下列判断合理的是
①硫酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
②能电离出氢离子的化合物都是酸
③Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物
④根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应
A.只有①②④ B.只有④⑤
C.只有①③⑤ D.只有①⑤
难度: 中等查看答案及解析
-
下列关于胶体与溶液的说法正确的是
A.向沸水中滴加饱和氯化铁溶液可制得氢氧化铁胶体
B.难溶物质和水形成的分散系不可能是胶体
C.氢氧化铁胶体通电后阴极附近红褐色加深,说明氢氧化铁胶体带正电
D.蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔现象
难度: 中等查看答案及解析
-
下列说法正确的是
A.CO2的水溶液能导电,所以CO2是电解质
B.氧化剂在反应中得到的电子越多,氧化能力越强
C.用加热法可分离I2和NH4HCO3两种固体
D.氧化性:Cl2>I2,还原性:I->Cl-
难度: 中等查看答案及解析
-
下列反应过程中溶液的导电性有显著变化的是
A.向NaOH溶液中滴加相同浓度的醋酸至完全中和
B.向Ba(OH)2溶液中滴加相同浓度的盐酸至完全中和
C.向Ba(OH)2溶液中滴加相同浓度的稀硫酸至沉淀完全
D.向BaCl2溶液中滴加相同浓度的硝酸银溶液至沉淀完全
难度: 中等查看答案及解析
-
下列说法正确的是
A.离子反应中反应物和生成物都是离子
B.有单质参加或生成的反应一定属于氧化还原反应
C.金属氧化物不一定是碱性氧化物,酸酐不一定是酸性氧化物
D.金属单质只能做还原剂,非金属单质只能做氧化剂
难度: 简单查看答案及解析
-
下列属于氧化还原反应,且在反应中水只作还原剂的是
A.2Na+2H2O=2NaOH+H2↑ B.2F2+2H2O=4HF+O2↑
C.CaO+H2O=Ca(OH)2 D.2Na2O2+2H2O=4NaOH+O2↑
难度: 简单查看答案及解析
-
在下列变化中,必须要加入合适的氧化剂才能实现的是
A.Na2O2→O2 B.CO2→CO C.Fe2O3→Fe D.Br - →Br2
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
B.钠可以从AgNO3溶液中置换出金属银
C.钠能与水反应,所以钠着火不能用水灭火,要用泡沫灭火器
D.Na2O、Na2O2、NaOH和NaHCO3均是强电解质
难度: 中等查看答案及解析
-
由相同条件下的三个反应:①2NaA +B2 =2NaB +A2; ②2NaC +A2 =2NaA +C2;③2NaB +D2 =2NaD +B2;可判断
A.氧化性:A2>B2>C2>D2 B.还原性:C->A->B->D-
C.2NaD +A2 =2NaA +D2可进行 D.2NaC+B2 =2NaB+C2不能进行
难度: 中等查看答案及解析
-
下列实验操作或叙述中正确的是
A.蒸发操作时,应使混合物中的水分完全蒸干后再停止加热
B.蒸馏时,温度计水银球需靠近蒸馏烧瓶支管口,冷凝水的流向需从冷凝管的上口进下口流出
C.过滤后洗涤沉淀时,应将固体转移至烧杯中,并加入适量蒸馏水充分搅拌后再过滤
D.分液时,先从分液漏斗下口放出下层液体,更换烧杯后再从上口放出上层液体
难度: 中等查看答案及解析
-
K2FeO4是优良的水处理剂,一种制备方法是将Fe2O3、KNO3、KOH混合共熔,反应为:Fe2O3+3KNO3+4KOH=2K2FeO4+3KNO2+2H2O,下列关于该反应的说法不正确的是
A.铁元素被氧化,氮元素被还原 B.氧化性:KNO3>K2FeO4
C.反应中转移电子数为生成K2FeO4的6 倍 D.K2FeO4具有氧化杀菌作用
难度: 中等查看答案及解析
-
下列叙述正确的是
A.Na2O与Na2O2中阴、阳离子的个数比均为1:2
B.足量Cl2、O2分别和两份等质量的Na反应,前者得到电子多
C.胃酸过多可用服用碳酸钠
D.钠投入水中会熔成小球,并四处游动,说明钠与水反应放热并生成氧气
难度: 简单查看答案及解析
-
下列选项中不能用如图表示物质或概念间从属关系的是
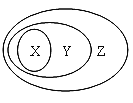
X
Y
Z
A
碱
电解质
化合物
B
离子反应
置换反应
氧化还原反应
C
胶体
分散系
混合物
D
碱性氧化物
金属氧化物
氧化物
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图所示,下列说法正确的是
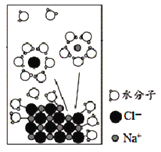
A.该过程发生了分解反应
B.离子从固体表面脱离后不会再回到固体表面
C.水合Na+的图示不科学
D.NaCl溶于水后发生了电离,是在通电条件下进行的
难度: 中等查看答案及解析
-
下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过
容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤加热坩埚要垫上石棉网
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管竖直伸入试管内滴加液体
⑨稀释浓硫酸时,应沿器壁缓缓地将水加入浓硫酸中
⑩用镊子从煤油中取出金属钠,再用小刀切一小块,然后将剩下的钠放回原瓶
A.①④⑦⑩ B.①④⑤⑦⑩ C.①④⑤⑦⑧⑩ D.④⑤⑦⑩
难度: 中等查看答案及解析
-
观察是研究物质性质的基本方法。一同学将一小块金属钠露置于空气中,观察到下列现象:银白色
变灰暗
变白色
表面潮湿
白色固体,下列说法不正确的是
A.①中钠发生了氧化反应 B.②变白色是因为生成了氢氧化钠
C.③发生物理变化 D.④生成了碳酸氢钠
难度: 简单查看答案及解析
-
下列关于离子的检验说法正确的是
A.向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有
B.向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有
C.向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的红色石蕊试纸靠近试管口,若试纸不变蓝,则说明该溶液中无
D.如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素
难度: 中等查看答案及解析
-
下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A.H+、I-、ClO-、Na+ B.Ag+、
、Cl-、K+
C.K+、Na+、Ca2+、
D.Cu2+、Fe2+、
、
难度: 中等查看答案及解析
-
下图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是
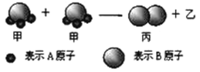
A.1个乙分子中含有2个A原子
B.该反应类型是分解反应
C.相对分子质量:Mr(甲)=Mr(乙)+Mr(丙)
D.该反应一定属于氧化还原反应
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.侯氏制碱法:NH3+CO2+H2O=
+
B.小苏打溶液与稀硫酸混合:
+2H+=CO2↑+H2O
C.向Ba(OH)2溶液中加少量NaHCO3:
+Ba2++OH-=BaCO3↓+H2O
D.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
难度: 中等查看答案及解析
-
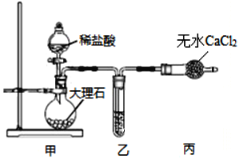
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A
B
C
D
实验
分离酒精和水
分离胶体和溶液
除去碳酸钠固体中的碳酸氢钠
比较碳酸钠和碳酸氢钠的稳定性
装置或仪器
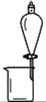
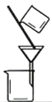
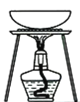
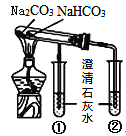
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
2个
恰好能氧化5个
,则还原产物中变价元素的化合价是
A.- 1 B.0 C.+1 D.+6
难度: 简单查看答案及解析
-
工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体N2和CO2。下列说法不正确的是( )
A.CN-中碳元素的化合价为+2 B.该反应的氧化产物是N2
C.反应中氧化剂和还原剂的系数比为5:2 D.该反应的还原产物为Cl-
难度: 简单查看答案及解析
-
Fe3+、SO42-、Al3+和X四种离子以个数比2:4:1:1大量共存于同一溶液中,X可能是( )
A.Na+ B.OH- C.CO32- D.Cl–
难度: 简单查看答案及解析
-
已知:还原性强弱:I- >Fe2+>Br-,向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示。下列说法中正确的是
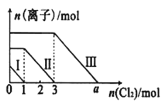
A.a值等于6
B.线段Ⅰ代表Br-的变化情况
C.线段Ⅲ代表Fe2+的变化情况
D.原混合溶液中n(FeBr2)=4mol
难度: 简单查看答案及解析