-
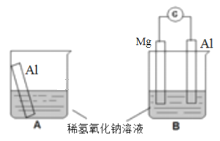
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲为负极;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种一金属的活动性顺序由大到小排列为
A. 甲>丙>丁>乙 B. 甲>丙>乙>丁
C. 甲>乙>丙>丁 D. 乙>丁>丙>甲
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 无论新制还是久置的氯水,滴加AgNO3溶液均生成白色沉淀
B. 氯水呈黄绿色,说明氯水中含有 Cl2
C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D. 向新制氯水中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 简单查看答案及解析
-
对于下列事实的解释正确的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸具有挥发性
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 氨气可以完成喷泉实验,说明氨气极易溶于水
难度: 中等查看答案及解析
-
检验氯化氢气体中是否混有氯气,可采用的方法是( )
A.用干燥的蓝色石蕊试纸 B.用干燥有色布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是( )
X
Y
Z
W
A. X的气态氢化物比Y稳定
B. W的最高价氧化物的水化物的酸性比Z强
C. Z的非金属性比Y强
D. X与Y形成的化合物都易溶于水
难度: 困难查看答案及解析
-
下列各组化合物中,化学键的类型完全相同的是( )
①CaCl2 和Na2S ②CO2 和CS2 ③Na2O 和Na2O2 ④HCl 和NaOH
A.①② B.①③ C.②③ D.②④
难度: 中等查看答案及解析
-
某种碱性氢氧燃料电池的的正极反应式为:O2+4e-+2H2O = 4OH-。下列有关该电池的叙述正确的是
A.工作时,电解质溶液中的OH-向正极移动
B.工作一段时间后,电解液中KOH的物质的量浓度减小
C.负极上发生的反应为H2-2e-= 2H+
D.若电池在工作过程中有0.4mol电子转移,则正极消耗2.24L O2
难度: 简单查看答案及解析
-
据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取一种叫做生物质纳米结构二氧化硅的超高活性材料,将少量这种材料掺入混凝土中,即可轻易制备出超高强度和超高耐久性能的高性能混凝土。关于二氧化硅下列说法中正确的是( )
A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物
B.二氧化碳通入硅酸钠溶液中可以得到硅酸
C.由CaCO3+SiO2
CaSiO3+CO2↑可知硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
难度: 中等查看答案及解析
-
下列关于硅及其化合物的说法中,正确的是( )
A.硅可用于制造光导纤维
B.水泥、玻璃、水晶饰物都是硅酸盐制品
C.可用反应Na2SiO3+2HCl═2NaCl+H2SiO3(胶体)制取硅酸
D.SiO2既能与HF反应又能与强碱反应,所以SiO2是两性氧化物
难度: 简单查看答案及解析
-
能证明碳酸的酸性比硅酸强的事实是
A. 二氧化碳溶于水且能反应生成碳酸,二氧化硅不溶于水不能与水反应生成硅酸
B. 在高温下,二氧化硅与碳酸钠能发生反应:SiO2+Na2CO3
Na2SiO3+CO2↑
C. 二氧化硅的熔点比二氧化碳的熔点高
D. 二氧化碳通入硅酸钠溶液中,生成白色胶状沉淀
难度: 简单查看答案及解析
-
实验室用下列方法制取氯气:①用含4 mol 氯化氢的浓盐酸与足量的二氧化锰反应;②用87 g 二氧化锰与足量浓盐酸反应,若不考虑氯化氢的挥发,则反应后所得氯气的物质的量( )
A.①比②多 B.②比①多 C.两种方法一样多 D.无法比较
难度: 中等查看答案及解析
-
下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A.
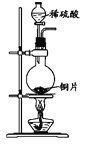 制取SO2 B.
制取SO2 B. 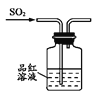 验证漂白性
验证漂白性C.
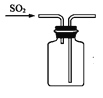 收集SO2 D.
收集SO2 D. 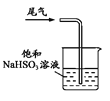 尾气处理
尾气处理难度: 中等查看答案及解析
-
将充满二氧化氮的试管倒立于盛有水的水槽中,充分放置后的现象正确的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列有关SO2的性质的探究实验报告记录的实验现象正确的是
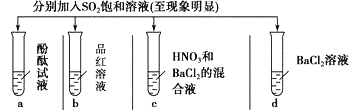
A
无色
无色
无现象
无色溶液
B
红色
无色
白色沉淀
白色溶液
C
无色
无色
白色沉淀
无色溶液
D
红色
无色
白色沉淀
白色溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列方法中,不能用于实验室制取氨的是
A. 加热试管中的氯化铵固体
B. 在烧瓶中将熟石灰和氯化铵混合,加水调成泥状后加热
C. 将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中
D. 将烧瓶中的浓氨水加热
难度: 中等查看答案及解析
-
探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO2

C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3 具有热不稳定性
D. 充分反应后,锥形瓶内有 NO3-存在
难度: 中等查看答案及解析
-
2016年IUPAC命名117号元素为Ts,下列说法不正确的是
A.Ts的原子核外最外层电子数是7
B.Ts是一种非金属元素
C.其中一种核素
的中子数为176
D.Ts在周期表的第七周期第VIIA族
难度: 简单查看答案及解析
-
已知a、b分别为ⅠA和ⅦA族的同周期两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是( )
A.n=m+6 B.n=m+10 C.n=m+16 D.n=m+30
难度: 简单查看答案及解析
-
含中子N个,X的质量数为A,则ag X的氢化物中含质子的物质的量是
A.
mol B.
mol
C.
mol D.
mol
难度: 中等查看答案及解析
-
下列物质发生变化时,所克服的粒子间相互作用属同种类型的是( )
A.亚硫酸氢钠和硫酸氢钠分别溶解在水中
B.硝酸铵与硝酸分别受热变为气体
C.氯化钠与氯化氢分别溶解在水中
D.碘与干冰分别受热变为气体
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
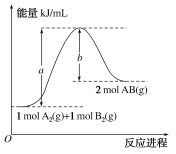
A.每生成2分子AB(g)吸收b kJ热量
B.该反应热ΔH=+(a-b) kJ/mol
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
难度: 简单查看答案及解析
-
已知H2S的燃烧热 ΔH=-akJ·mol-1,下列热化学方程式正确的是( )
A. 2H2S(g) + O2(g)=2H2O(g) + 2S(s) ΔH=-akJ·mol-1
B. 2H2S(g) + O2(g)=2H2O(l) + 2S(s) ΔH=-akJ·mol-1
C. 2H2S(g) + 3O2(g)=2H2O(l) + 2SO2(g) ΔH=-akJ·mol-1
D. 2H2S(g) + 3O2(g)=2H2O(l) + 2SO2(g) ΔH=-2akJ·mol-1
难度: 简单查看答案及解析
-
氢氧燃料电池已用于航天飞机,其工作原理如图所示。关于该燃料电池的说法不正确的是
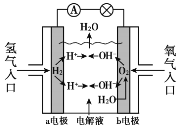
A. H2在负极发生氧化反应
B. 电子从a电极经外电路流向b电极
C. 供电时的总反应为:2H2 + O2 == 2H2O
D. 燃料电池的能量转化率可达100%
难度: 中等查看答案及解析
-
一定温度下,反应N2(g)+O2(g)⇌2NO(g)在密闭容器中进行,下列措施不改变化学反应速率的是( )
A.缩小体积使压强增大 B.恒容,充入N2
C.恒容,充入He D.恒压,充入He
难度: 简单查看答案及解析
-
下列四个数据都表示合成氨的反应速率,其中速率相等的是( )
①υ (N2)=0.6mol/(L·min) ②υ (NH3)=1.8mol/(L·min)
③υ (H2)=1.2mol/(L·min) ④υ (H2)=0.045mol/(L·s)
A.①② B.①③ C.③④ D.②④
难度: 简单查看答案及解析