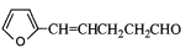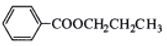-
糖尿病患者的尿样中含有葡萄糖,在与新制的氢氧化铜悬浊液共热时,能产生红色沉淀。说明葡萄糖分子中含有 ( )
A.苯基 B.甲基 C.羟基 D.醛基
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 油脂的水解反应称为皂化反应
B. 淀粉、蛋白质均含有C、H、O、N、P等元素
C. 酶是一种常见的催化剂,温度越高,催化活性越强
D. 向鸡蛋清溶液中加入饱和硫酸钠溶液会析出白色沉淀,加水沉淀会重新溶解
难度: 中等查看答案及解析
-
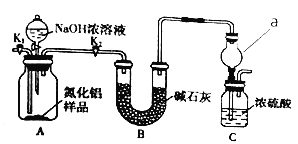
用下列装置不能达到有关实验目的的是
A.用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水)
B.用乙图装置制备Fe(OH)2
C.用丙图装置制取金属锰
D.用丁图装置比较NaHCO3和Na2CO3的热稳定性
难度: 中等查看答案及解析
-
汉黄芩素对肿瘤细胞的杀伤有独特作用,其结构如图所示,下列有关叙述正确的是( )
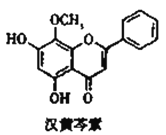
A. 汉黄芩素的分子式为C16H14O5
B. 1mol该物质与NaOH溶液反应,可消耗2molNaOH
C. 1mol该物质与溴水反应,最多消耗1molBr2
D. 该物质可发生取代、加成、缩聚、消去反应
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法正确的是( )
A. 7.8g苯所含碳碳双键数目为0.3NA
B. 28g乙烯所含共用电子对数目为6NA
C. 标准状况下,11.2 L溴乙烷所含分子数为0.5NA
D. 26g乙炔和苯乙烯的混合物,含有原子总数为6NA
难度: 中等查看答案及解析
-
CPAE是蜂胶的主要活性成分,它可由咖啡酸合成,其合成过程如下。下列说法不正确的是

A.咖啡酸的分子式为C9H8O4
B.咖啡酸可发生加聚反应,并且所得聚合分子中含有3种官能团
C.1 mol CPAE与足量的NaOH溶液反应,最多消耗3molNaOH
D.1 mol CPAE与足量H2反应,最多消耗7 mol H2
难度: 简单查看答案及解析
-
工业上常将铬镀在其他金属表面,同铁、镍组成各种性质的不锈钢,在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电板上无气体产生,铬电极上产生大量有色气体,则下列叙述正确的是
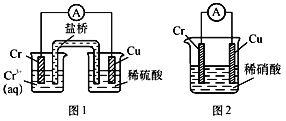
A. 图1为原电池装置,盐桥中的阴离子移向Cu电极的烧杯中
B. 由实验现象可知:金属活动性Cu>Cr
C. 图2装置中Cu电极上发生的电极反应式为:Cu-2e-=Cu2+
D. 两个装置中,电子均由Cr电极流向Cu电极
难度: 中等查看答案及解析
-
砷酸(H3AsO4)是三元弱酸,剧毒,可用于制备颜料、砷酸盐、杀虫剂等。常温下,其溶液中含砷的各微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。在常温下,下列说法错误的是
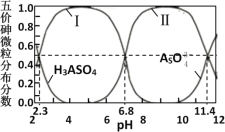
A.曲线Ⅱ代表HAsO
的分布分数
B.该砷酸溶液:Ka2/Ka3=104.6
C.等物质的量浓度的H3AsO4溶液和NaOH溶液等体积混合后所得溶液:pH>7
D.0.1mol/L的Na2HAsO4溶液中: c(HAsO
)> c(H2AsO
)> c(AsO
)
难度: 困难查看答案及解析
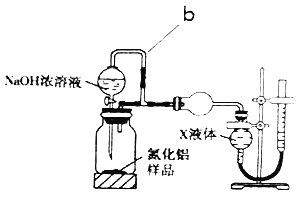
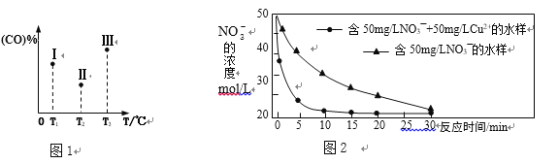
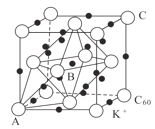

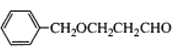 B.
B.