-
X、Y、Z、W四种短周期元素,原子的核电荷数依次增多,X的一种原子无中子,Y、Z形成的化合物具有漂白性,其中的原子个数比为1:1,W的单质常用于自来水的杀菌消毒,下列说法正确的是( )
A.X与Y、Z、W形成的化合物既有共价化合物也有离子化合物
B.X、Y、W三元素形成的酸都是弱酸
C.上述元素的简单离子的半径大小顺序为:r(X)<r(Y)<r(Z)<r(W)
D.Z、X形成的化合物与含酚酞的水反应后呈红色,生成的气体能使带火星的木条复燃
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.工业合成氨是一种人工固氮方法 B.侯氏制碱法应用了物质溶解度的差异
C.播撒碘化银可实现人工降雨 D.铁是人类最早使用的金属材料
难度: 简单查看答案及解析
-
下列物质的性质和用途不存在因果关系的是
A.胶体具有电泳的性质,可向豆浆中加入盐卤制作豆腐
B.醋酸酸性强于碳酸,用醋酸溶液清除热水器中的水垢
C.小苏打受热易分解,在面粉中加入适量小苏打焙制糕点
D.氧化铝熔点高,可作耐高温材料
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数,下列说法正确的是( )
A.标准状况下,560mL的氢气和氯气的混合气体充分反应后共价键数目为0.05NA
B.标准状况下,2.24LCl2通入NaOH溶液中反应转移的电子数为0.2NA
C.常温常压下,1.5molHCHO和C2H2O3的混合物完全充分燃烧,消耗的O2分子数目为1.5NA
D.0.1mol/L的NH4Cl溶液中通入适量氨气呈中性,此时溶液中NH4+数目为NA
难度: 中等查看答案及解析
-
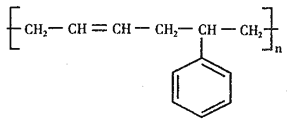
有机物a为某种感冒药的同系物,其结构简式如图所示,下列说法正确的是( )
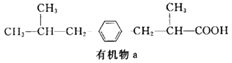
A.1mol有机物a最多可与4molH2发生加成反应
B.有机物a的化学式为C14H22O2
C.0.1mol有机物a与足量的NaHCO3溶液完全反应得到气体的体积为2.24L
D.有机物a苯环上的二氯代物有4种(不含立体异构)
难度: 中等查看答案及解析
-
微生物燃料电池在净化废水(含有Cr2O
离子)的同时能获得能源或得到有价值的化学产品,图为其工作原理。下列说法正确的是( )
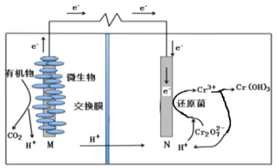
A.M为电源负极,有机物被还原
B.电池工作时,N极附近溶液pH减小
C.处理1molCr2O
时有14molH+从交换膜左侧向右侧迁移
D.Cr2O
离子浓度较大时,可能会造成还原菌失活
难度: 中等查看答案及解析
-
短周期主族元素 X、Y、Z、Q、R 的原子序数依次增大,X 的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q 的单质与稀硫酸剧烈反应生成 X 的单质。向100mLX2R的水溶液中缓缓通入RZ2 气体,溶液pH与RZ2 体积关系如下图。下列说法正确的是( )
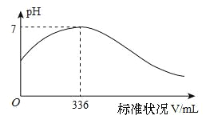
A.X2R 溶液的浓度为0.03mol·L-1
B.最简单气态氢化物的稳定性:Y>Z>R
C.工业上通常采用电解法冶炼Q的单质
D.RZ2 通入 BaCl2、Ba(NO3)2 溶液中,均无明显现象
难度: 困难查看答案及解析


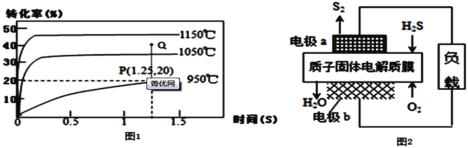
 。利用有机物A合成PET的路线如下图所示:
。利用有机物A合成PET的路线如下图所示: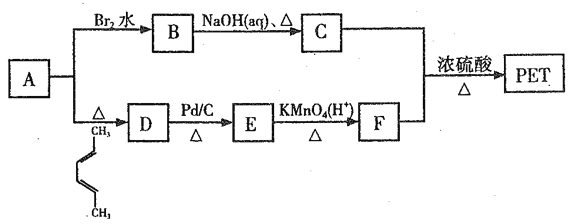
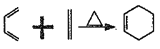 ;②
;② 。
。 )的合成路线_______________。
)的合成路线_______________。