-
化学与环境、科学、技术密切相关。下列有关说法中正确的是( )
A.华为首款5G手机搭载了智能的7nm制程SoC麒麟980芯片,此芯片主要成分是二氧化硅
B.用于制作N95型口罩的“熔喷布”主要原料是聚丙烯,聚丙烯的分子长链上无支链
C.国产飞机C919用到的氮化硅陶瓷是传统有机非金属材料
D.侯氏制碱法的工艺过程中应用了物质溶解度的差异
难度: 简单查看答案及解析
-
设NA是阿伏加德罗常数的值。下列说法正确的是( )
A.1molNaHSO4固体中含有离子总数为3NA
B.11.2L(标准状况)HF含有质子数为5NA
C.50g46%的乙醇水溶液中,含有O—H键数为3.5NA
D.1molCu与足量的硫蒸气反应,转移电子数为2NA
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色晶体。下列说法正确的是( )
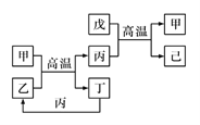
A.W的原子半径大于Z,金属性强于Z
B.W元素在周期表中的位置是第四周期VIIIB族
C.可以通过电解熔融的己来制备戊
D.X和Y形成的化合物中只含极性共价键
难度: 中等查看答案及解析
-
下列装置能达到实验目的的是( )
A.熔化Na2CO3
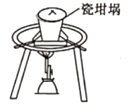
B.保存液溴
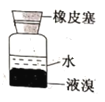
C.分液,先放出水层,再倒出溴的苯溶液
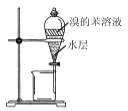
D.进行中和热的测定
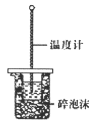
难度: 简单查看答案及解析
-
冠病毒(如图)由蛋白质和核酸组成,核酸由核苷酸组成.核苷酸的单体由五碳糖 、磷酸基和含氮碱基构成.下列说法错误的是

A.蛋白质和核酸均是高分子化合物
B.蛋白质中含C、H、O、N 等元素
C.五碳糖( C5H10O5)与葡萄糖互为同系物
D.NaClO溶液用作消毒剂,是因为NaClO 能使病毒蛋白变性
难度: 中等查看答案及解析
-
MOF衍生碳纳米棒封装的氧化铋催化剂对CO2电化学法制取HCOOH具有快速高效的选择性。其原理图如图,下列有关说法正确的是

A.该方法可有效消除CO2对大气造成的污染
B.该电极应与电源的正极相连
C.该电极反应式为:CO2-2e-+2H+=HCOOH
D.选择使用其他催化剂可能得到HCHO或CH3OH等产物
难度: 中等查看答案及解析
-
某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25.00mL0.1mol·L-1NaHCO3溶液中滴入等体积、等浓度CaCl2溶液,电导率以及pH变化曲线如图所示。下列说法错误的是( )
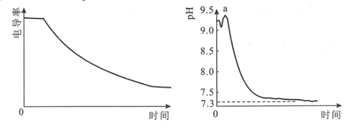
A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低
B.a点后pH下降的原因是Ca2+促进HCO3
H++CO
平衡右移
C.pH=7.3时,溶液中溶质主要为NaCl、CaCl2
D.可用0.1mol·L-1CaCl2溶液鉴别浓度均为0.1mol·L-1的NaHCO3和Na2CO3溶液
难度: 困难查看答案及解析




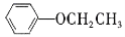 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品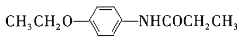 的路线为__(其他无机试剂任)。
的路线为__(其他无机试剂任)。