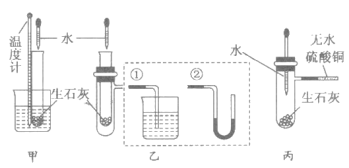
-
对以下科学家的发明发现,分析不合理的是( )
A.屠呦呦研究小组发现抗疟新药青蒿素,帮助很多人摆脱了疟疾的威胁
B.侯德榜制碱法,最终制得纯碱的化学式为:NaHCO3
C.阿伏加德罗提出分子学说,使人们对物质结构的认识发展到一个新的阶段
D.门捷列夫发现元素周期律,使化学的研究变得有规律可循
难度: 简单查看答案及解析
-
室温下,有两种溶液:①0.01mol•L-1NH3•H2O溶液、②0.01mol•L-1NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是( )
A.通入少量HCl气体
B.加入少量NaOH固体
C.加入少量H2O
D.适当升高温度
难度: 中等查看答案及解析
-
下列各项叙述中,正确的是( )
A.N、P、As的电负性随原子序数的增大而增大
B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C.2p和3p轨道形状均为纺锤形,能量也相等
D.C、N、O的气态氢化物稳定性依次减弱
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A.2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ•mol-1,则氢气的燃烧热为241.8kJ•mol-1
B.已知C(石墨,s)=C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则该反应中和热的热化学方程式为:NaOH+HCl=NaCl+H2O △H=-57.4kJ•mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2,则△H1<△H2
难度: 中等查看答案及解析
-
化学与社会、生产、生活密切相关,下列说法不正确的是
A.煤的气化、液化和干馏都是化学变化,是实现煤的综合利用的有效途径
B.海水淡化可以解决淡水危机,用光催化分解代替电解水制氢气可实现节能环保
C.我国油品从国IV汽油升级到国V汽油,有助于减少酸雨、雾霾,提高空气质量
D.天然气、沼气和太阳能分别属于化石能源、可再生能源和二次能源
难度: 中等查看答案及解析
-
第一位人工合成有机物的化学家是
A.门捷列夫 B.维勒 C.海维西 D.李比希
难度: 简单查看答案及解析
-
美国亚利桑那州大学和阿贡国家实验室的科学家最近设计出生产氢气的人造树叶,原理为2H2O(g)
2H2(g)+O2(g)。有关该反应的说法错误的是( )
A.没有人造树叶和太阳能的作用该反应不能自发进行
B.该反应最终是将太阳能转化为电能
C.该反应为充分利用太阳能开辟了广阔前景
D.氢能是理想的绿色能源
难度: 简单查看答案及解析
-
C2H6+Cl2
C2H5Cl+HCl的反应类型为
A. 取代反应 B. 加成反应
C. 酯化反应 D. 消去反应
难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s) ΔH>0,下列叙述正确的是( )
A. 加入少量W,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动
D. 平衡后加入X,上述反应的ΔH增大
难度: 简单查看答案及解析
-
一定条件下,体积为2L的密闭容器中,1molX和3molY进行反应:X(g)+3Y(g)
2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为1/8mol/(L·S)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的1/5
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0 ,升高温度,平衡常数K减小
难度: 中等查看答案及解析
-
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。下列叙述错误的是
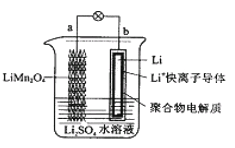
A.a为电池的正极
B.电池充电反应为LiMn2O4
Li1-xMn2O4+xLi
C.放电时,a极锂的化合价发生变化
D.放电时,溶液中Li+从b向a迁移
难度: 中等查看答案及解析
-
用一种试剂能鉴别苯酚溶液、己烯、己烷、乙醇四种无色透明液体,这种试剂是( )
A.酸性KMnO4 溶液 B.饱和溴水
C.紫色石蕊溶液 D.FeCl3溶液
难度: 困难查看答案及解析
-
不溶于水且比水轻的一组液体是
A.甲苯、四氯化碳 B.苯、汽油 C.硝基苯、一氯丙烷 D.酒精、溴
难度: 简单查看答案及解析
-
线型PAA(
)具有高吸水性,网状PAA在抗压性、吸水性等方面优于线型PAA。网状PAA的制备方法是:将丙烯酸用NaOH中和,加入少量交联剂a,再引发聚合。其部分结构片段如下:

下列说法不正确的是( )
A. 线型PAA的单体不存在顺反异构现象
B. 交联剂a的结构简式是
C. 形成网状结构的过程发生了加聚反应
D. PAA的高吸水性与—COONa有关
难度: 中等查看答案及解析
-
下列有关电解质溶液的叙述正确的是
A.同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7
B.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
C.含1 mol KOH的溶液与1 mol CO2完全反应后,溶液中c(K+)=c(HCO3-)
D.在CH3COONa溶液中加入适量CH3COOH,可使c(Na+)=c(CH3COO-)
难度: 中等查看答案及解析
-
下列实验现象与结论不一致的是
选项
实验操作
实验现象
结论
A
等体积等浓度的HA和HB两种酸分别与足量的锌反应,用排水法收集气体
HA放出氢气的反应速率更快
酸性:HB<HA
B
以铜、铁、浓硝酸构成原电池
铁表面有红棕色气泡产生
铜作原电池的负极
C
向25 mL冷水和沸水中分别滴入5滴FeCl3饱和溶液
前者为黄色,后者为红褐色
升高温度,Fe3+的水解程度增大
D
将固体CaSO4加入Na2CO3饱和溶液中
一段时间后,检验固体主要成分为CaCO3
K sp ( CaSO4) < K sp ( CaCO3 )
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
下列说法正确的是
①常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
②为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
③相同温度下,将足量氯化银固体分别放入相同体积的a.蒸馏水b.0.1mol·L-1盐酸、c.0.1mol·L-1氯化镁溶液d.0.1mol·L-1硝酸银溶液中,Ag+浓度:a>d=b>c
④用0.2000mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol·L-1),至中性时,溶液中的酸未被完全中和
⑤将水加热到100℃,pH=6:c(OH)< c(H+)
⑥醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)> c(Na+)
⑦0.lmoI·L-1的硫酸铵溶液中:c(
)> c(
)> c(H+)
⑧pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)= c(H+)
A.③⑤ B.①⑧ C.④⑦ D.②⑥
难度: 中等查看答案及解析
-
某同学测得物质的量浓度均为0.01 mol/L CH3COOH和CH3COONa混合溶液呈酸性后,得出了关系式,你认为其中不正确的是 ( )
A.c(CH3COOH) < c(Na+)
B.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.c(CH3COOH)+ c(H+) = c(CH3COO-)+ c(OH-)
D.c(CH3COOH)+c(CH3COO-)=0.02mol/L
难度: 简单查看答案及解析
-
为获得电能,某实验小组设计了如图装置,若向容器中加入_______可以使装置中电流计的指针发生偏转。
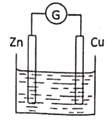
A.汽油 B.食醋 C.蔗糖溶液 D.纯水
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B.0.1mol·L-1氨水加水稀释后,溶液中
的值减小
C.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0
难度: 中等查看答案及解析
-
把过量的CO2气体通入下列物质的饱和溶液中,不变浑浊的是( )
A.Ca(OH)2 B.C6H5ONa C.NaAlO2 D.Na2SiO3
难度: 简单查看答案及解析