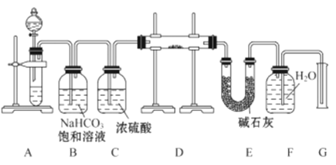
-
下列物质性质的变化规律与分子间作用力有关的是( )
A. HF、HCl、HBr、HI的热稳定性依次减弱
B. 金刚石的硬度大于硅,其熔、沸点也高于硅
C. NaF、NaCl、NaBr、NaI的熔点依次降低
D. F2、Cl2、Br2、I2的沸点依次升高
难度: 中等查看答案及解析
-
草酸(分子式为H2C2O4,沸点:150℃)是生物体的一种代谢产物,广泛分布于植物、动物和真菌体中。下列有关判断不正确的是( )
A.45g草酸中含有1.204×1024个氧原子
B.1mol草酸中含有6.02×1023个分子
C.草酸的摩尔质量是90g/mol
D.1mol草酸在标准状况下的体积约为22.4L
难度: 中等查看答案及解析
-
化学与生活密切相关,下列有关说法正确的是 ( )
A. 糖类、蛋白质、油脂都属于天然高分子化合物
B. 油脂是产生能量最高的营养物质
C. 石油裂化的主要目的是为了获得芳香烃
D. 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分开
难度: 简单查看答案及解析
-
已知A、B、C、X均为中学化学常见物质,一定条件下它们有如右图所示转化关系(其它产物已略去),下列说法错误的是( )

A. 若A为AlCl3,则X可能为KOH溶液 B. 若X为O2,A可能是C
C. 若A是强碱,则C可能是酸式盐 D. A也有可能是Mg
难度: 困难查看答案及解析
-
下列离子方程式正确的是
A. 铝与盐酸反应:Al+6H+=Al3++3H2↑
B. 少量CO2通入澄清石灰水中:CO2+2OH-=CO32-+H2O
C. 向饱和碳酸钠溶液中充入过量二氧化碳:2Na++CO32﹣+ CO2+H2O=2NaHCO3↓
D. 氧化铜与稀硫酸反应:H++CuO=Cu2++H2O
难度: 困难查看答案及解析
-
葡萄酸的结构简式为
 。下列有关葡萄酸说法不正确的是( )
。下列有关葡萄酸说法不正确的是( )A.葡萄酸能发生取代反应 B.葡萄酸既能与乙醇发生酯化反应,也能与乙酸发生酯化反应
C.葡萄酸能与Na和NaOH反应 D.葡萄酸能使溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
下列关于Na2CO3和NaHCO3的说法中,不正确的是( )
A.热稳定性:Na2CO3>NaHCO3
B.常温下在水中的溶解度:Na2CO3>NaHCO3
C.Na2CO3溶液和NaHCO3溶液可用澄清石灰水鉴别
D.相同物质的量Na2CO3和NaHCO3与盐酸完全反应,产生的CO2一样多,消耗HCl的物质的量之比为2:1
难度: 中等查看答案及解析
-
硅及其化合物的应用范围很广。下列说法正确的是
A.硅是人类将太阳能转换为电能的常用材料
B.粗硅制备单晶硅不涉及氧化还原反应
C.反应:Si+2NaOH+H2O=Na2SiO3+2H2↑中,Si为还原剂,NaOH和H2O为氧化剂
D.硅能与氢氟酸反应,则硅可以与盐酸反应
难度: 简单查看答案及解析
-
煤的气化是煤高效、洁净利用的方向之一。如图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图。由图可知该煤气中
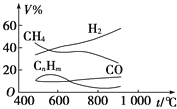
A.只含有碳、氢两种元素
B.所含的有机物是CH4、CnHm
C.CO体积分数大于CH4体积分数
D.低温有助于提高H2的含量
难度: 中等查看答案及解析
-
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下图所示,其中Q是无机非金属材料的主角。下列判断正确的是
R
T
Q
W
G
A.离子半径:T<W<G
B.最简单气态氢化物的热稳定性:Q<R
C.最高价氧化物对应水化物的酸性:Q>W>G
D.T和G组成的化合物甲溶于水,其水溶液呈中性
难度: 中等查看答案及解析
-
下列关于烷烃与烯烃的性质及反应类型的叙述正确的是
A. 烷烃只含有饱和键,烯烃只含有不饱和键
B. 烷烃不能发生加成反应,烯烃不能发生取代反应
C. 烷烃的通式一定是CnH2n+2,而烯烃的通式一定是CnH2n
D. 烷烃与烯烃相比,发生加成反应的一定是烯烃
难度: 简单查看答案及解析
-
下列实验方案中,不能达到相应实验目的的是
A
B
C
D
方
案
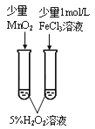
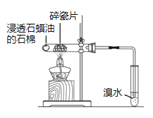
向蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热
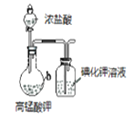
目
的
验证不同催化剂对化学反应速率的影响
验证石蜡油分解的产物中含有与烷烃性质不同的烃
检验蔗糖水解产物中是否含有葡萄糖
比较Cl2、I2的氧化性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于烃的说法正确的是
A.苯和甲苯均能使酸性高锰酸钾溶液褪色
B.CH2=C(CH3)-CH=CH2与等物质的量的溴反应产物仅有2种
C.分子式为C8H10且属于芳香烃的同分异构体有3种
D.等质量的乙烷、乙烯完全燃烧消耗氧气的量前者多
难度: 简单查看答案及解析
-
在溶液中加入足量Na2O2后仍能大量共存的离子组是
A.
、Ba2+、Cl-、
B.K+、
、Cl-、
C.Ca2+、Mg2+、
、
D.Na+、Cl-、
、I-
难度: 简单查看答案及解析
-
日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O。有关锌-锰干电池的叙述中,正确的是
A.锌-锰干电池中锌筒为正极,石墨棒为负极
B.锌-锰干电池即使不用,放置过久,也会失效
C.锌-锰干电池工作时,电流方向是由锌筒经外电路流向石墨棒
D.锌-锰干电池可实现化学能向电能和电能向化学能的相互转化
难度: 中等查看答案及解析
-
下列有关离子(或物质)的检验及结论,不正确的是 ( )
A.用丁达尔效应可鉴别FeCl3溶液和Fe(OH)3胶体
B.在某未知成分的溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有CO32-
C.向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有SO42-
D.氨气能使湿润的红色石蕊试纸变蓝,说明氨气的水溶液呈碱性
难度: 中等查看答案及解析