-
下列溶液中有关物质的量浓度关系不正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) +c(M+) ==c(OH-) +c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) = 2c(H+) +c(CH3COOH)
D.0.1 mol/L的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2—)
难度: 困难查看答案及解析
-
关于化学与生活、化学与生产,下列说法正确的是( )
A. 泡沫灭火器的成分为Al2(SO4)3溶液和Na2CO3溶液,二者接触后因发生双水解反应而快速产生CO2
B. 工业上常用NH4Cl溶液除锈,利用了NH4Cl溶液水解显酸性
C. 工业电解精炼铜用粗铜作阳极,纯铜作阴极,CuSO4溶液作电解质溶液,相同时间段内阴极和阳极的质量变化相等
D. 为了延缓海水中钢闸门的腐蚀,常将钢闸门与直流电源的负极相连,该方法为牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 1L 0.1mol/L的NaF溶液中离子总数大于0.2 NA
B. 1L 0.01mol/L的醋酸溶液中H+的数目为0.01NA
C. 质量均为1.5g —CH3和CH3- 所含的电子数均为NA
D. CH3OH---O2燃料电池中,如若正极消耗O211.2L,则电路中转移的电子数为2 NA
难度: 中等查看答案及解析
-
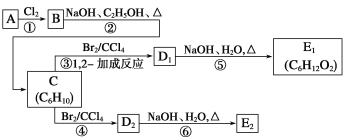
关于有机化合物下列说法正确的是( )
A. 直链烷烃正戊烷的所有碳原子在一条直线上
B. 分子式为C5H10O2的有机物能与NaHCO3溶液反应放出CO2的同分异构体有4种
C. 甲烷中混有乙烯,可直接将混合物通入酸性KMnO4中除去乙烯得到纯净的甲烷
D. 甲苯和液溴在FeBr3作催化剂的条件下可发生取代反应生成4种一溴代物
难度: 中等查看答案及解析
-
表示下列变化的化学用语正确的是
A.NaHCO3溶液显碱性:HCO
+H2O
CO
+OH-
B.醋酸溶液显酸性:CH3COOH=CH3COO-+H+
C.氨水显碱性:NH3·H2O
NH
+OH-
D.铁在潮湿空气中被腐蚀的负极反应:Fe-3e- =Fe3+
难度: 简单查看答案及解析
-
如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )
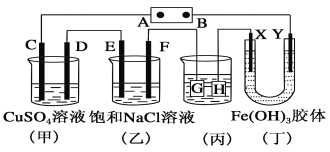
A.电源B极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO
、SO
、Na+
B.由水电离的c(H+)=1×10-14 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的溶液中:NH
、Al3+、NO
、Cl-
D.c(Fe3+)=0.1 mol•L-1的溶液中:K+、CO
、NO
、SCN-
难度: 简单查看答案及解析
-
当电池工作时,下列说法错误的( )
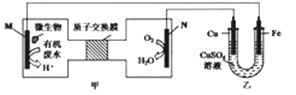
A. 甲池中N极的电极反应式为:O2+4e-+4H+=2H2O
B. 当N极消耗5.6L(标准状况下)O2时,铁极增重32g
C. 电子的流动方向为M→Fe→CuSO4溶液→Cu→N
D. M极上发生的是氧化反应
难度: 中等查看答案及解析