-
短周期主族元素X、Y、Z、W的原子序数依次增大,甲、乙分别是X、W两元素对应的单质,丙、丁是由这些元素组成的二元化合物,戊是Z的最高价氧化物对应的水化物,且25℃时0.1mol/L 戊溶液的pH为13,工业上通过电解丙和丁的混合物来制取甲、乙、戊。下列说法不正确的是( )
A. 原子半径:Z>W>Y>X
B. Z分别与X、Y、W形成的化合物中一定没有共价键
C. 元素Y与X、Z都能组成两种化合物
D. 乙与戊的水溶液反应后所得溶液具有漂白性
难度: 困难查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B.22.4 L(标准状况)氩气含有的质子数为18 NA
C.92.0 g甘油(丙三醇)中含有羟基数为1.0 NA
D.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0 NA
难度: 简单查看答案及解析
-
下列有关叙述正确的是
A.汽车尾气中含有的氮氧化物是汽油不完全燃烧造成的
B.酒精能使蛋白质变性,酒精纯度越高杀菌消毒效果越好
C.电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
D.硅胶、生石灰、铁粉是食品包装中常用的干燥剂
难度: 简单查看答案及解析
-
下列设计的实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
探究化学反应的
限度取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
B
探究浓度对化学反应速率的影响
用两支试管各取5mL0.1mol/L的KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/L的草酸溶液,记录溶液褪色所需的时间
C
证明溴乙烷的消去反应有乙烯生成
将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入酸性KMnO4溶液中
D
验证醋酸钠溶液中存在水解平衡
取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体其水溶液呈中性,观察溶液颜色变化
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
我国科研人员研制出一种室温“可呼吸”Na-CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有
转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是( )

A.“吸入”CO2时的正极反应:4Na++ 3CO2+ 4e-= 2Na2CO3+ C
B.“吸入”CO2时,钠箔为正极
C.“呼出”CO2时,Na+向多壁碳纳米管电极移动
D.标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
难度: 困难查看答案及解析
-
下列叙述正确的是
A. 甲苯与足量H2加成产物的一氯取代物有5种
B.
由3种单体加聚得到
C. 双糖、多糖在稀酸的催化下最终均水解为葡萄糖
D. 分子式为C4H6O2并能与饱和NaHCO3溶液反应生成CO2的有机物有3种(不含立体异构)
难度: 中等查看答案及解析
-
常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5,下列说法正确的是( )
A.将CH3COONa溶液从20℃升温至30℃,溶液中
增大
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C.0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-)=c(HCOOH) + c(H+)
D.0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-)>c(Cl- )>c(CH3COOH)>c(H+)
难度: 中等查看答案及解析



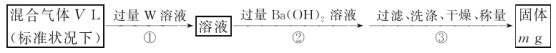
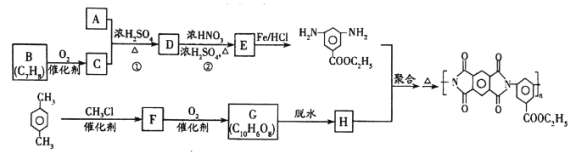
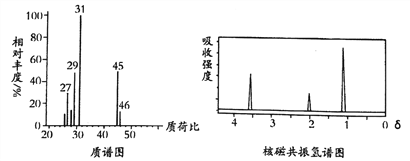
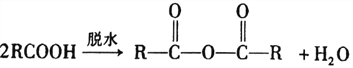
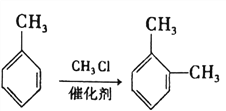
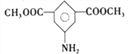 的合成路线:_______________________。
的合成路线:_______________________。