-
中国科研提供抗疫“硬核力量”,在对新冠病毒的认识与防控中,化学知识起到了重要作用。下列说法不正确的是
A.为了防止蛋白质变性,病毒疫苗一般需要冷藏存放
B.在选用酒精消毒时,75%的酒精溶液比95%的杀菌效果好
C.新冠病毒DNA分子内存在氢键,氢键具有一定的方向性和饱和性
D.聚丙烯是生产医用口罩熔喷布的主要原料,其单体分子中碳原子均以sp2杂化
难度: 中等查看答案及解析
-
反应Cl2+2NaOH=NaCl+NaClO+H2O,可用于工业上制取漂白精。下列表示反应中相关微粒的化学用语正确的是
A.NaOH的电子式:Na:
:H
B.中子数为18的Cl原子:
Cl
C.Na的结构示意图:
D.NaClO的水解方程式:ClO-+H2O=HClO+OH-
难度: 简单查看答案及解析
-
下列物质性质与用途具有对应关系的是
A.氨气易液化,可用作制冷剂
B.溴化银具有感光性,可用于人工降雨
C.氯化铁具有氧化性,可用了自来水的杀菌消毒
D.氢氧化铝能与氢氧化钠反应,可用于治疗胃酸过多
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在水电离出的H+浓度为1.0×10-13mol·L-1:Na+、K+、
、
B.使甲基橙呈红色的溶液中,可能大量存在的是:
,K+、ClO−、
C.某无色溶液中可能大量存在:Al3+、Ba2+、
、H+
D.0.1 mol·L−1NH3·H2O溶液:K+、Fe3+、
、SCN-
难度: 中等查看答案及解析
-
用下列实验装置进行相应的实验,能达到实验目的的是
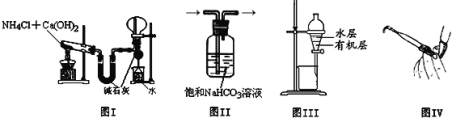
A.图I用于实验室制氨气并收集干燥的氨气
B.图II用于除去Cl2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV用于检查碱式滴定管是否漏液
难度: 中等查看答案及解析
-
硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )
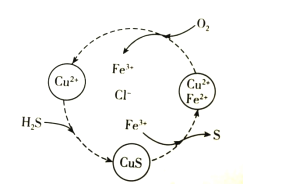
A.在图示的转化中,Fe3+和CuS是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是2H2S+O2
2S+2H2O
D.当有1molH2S转化为硫单质时,需要消耗O2的物质的量为0.5mol
难度: 中等查看答案及解析
-
下列离子方程式书写正确旳是 ( )
A.碳酸氢铵和足量旳氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O
B.三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+
C.用稀硝酸浸泡做过银镜反应旳试管:Ag+2H++NO3-=Ag++NO2↑+H2O
D.偏铝酸钠溶液中通入过量旳二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y2+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.X的氢化物只含有极性共价键
B.Y单质可通过电解Y的氯化物获得
C.W与氢形成的原子比为1︰1的化合物有多种
D.W与Z形成化合物WZ2中各原子均满足8电子稳定结构
难度: 简单查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是 ( )
A.Fe
FeCl2
Fe(OH)2
B.S
SO3
H2SO4
C.CaCO3
CaO
CaSiO3
D.NH3
NO
HNO3
难度: 简单查看答案及解析
-
我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主法错误的是
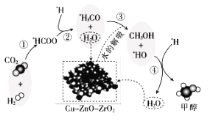
A.第①步中CO2和H2分子中都有化学键断裂
B.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
C.第④步反应是一个放热过程
D.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
难度: 中等查看答案及解析
-
下列说法正确的是
A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
B.若在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀
C.1molNa2O2与足量H2O反应产生O2,理论上转移的电子数约为2×6.02×1023
D.用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
难度: 中等查看答案及解析
-
在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO(g)+SO2(g)
2CO2(g)+S(l)。以疏松多孔的γAl2O3作为催化剂(其他条件相同),反应相同的时间,SO2的去除率随反应温度的变化如图所示(图中虚线表示相同条件下SO2的平衡去除率随温度的变化)。下列说法正确的是
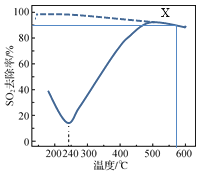
A.该反应的ΔH>0
B.180℃,SO2去除率较高的主要原因是SO2被γAl2O3吸附
C.500℃时,其他条件不变,采用高效的催化剂可以提高SO2去除率
D.X点恒容下再通入CO、CO2各0.1 mol,达到平衡前v(正)>v(逆)
难度: 困难查看答案及解析
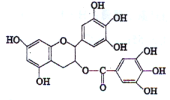
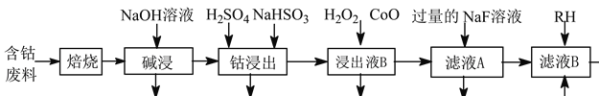
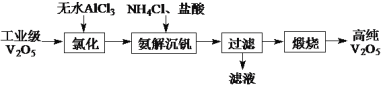
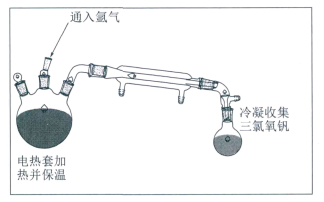
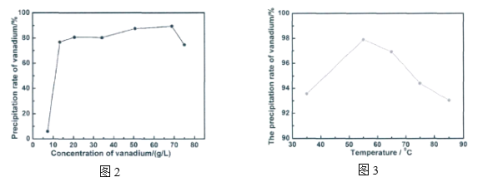
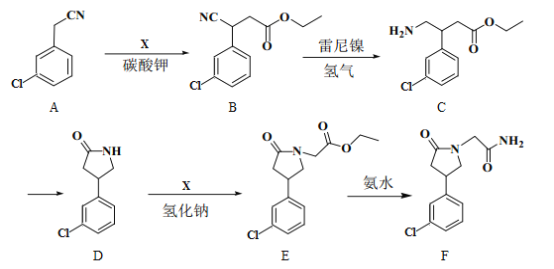
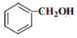 )和
)和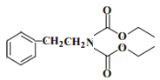 (结构如图)的合成路线流程图__________________(无机试剂任用,合成路线流程图示例见本题题干)。
(结构如图)的合成路线流程图__________________(无机试剂任用,合成路线流程图示例见本题题干)。