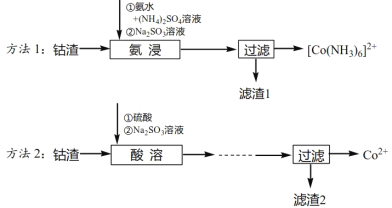
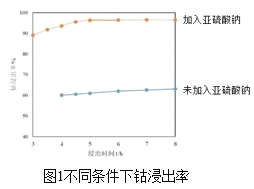
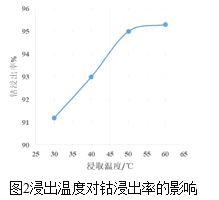
-
历史文物蕴含丰富的化学知识。下列关于历史文物的描述中,错误的一项是( )
选项
A
B
C
D
图片

战国·曾侯乙编钟

《竹林七贤与启荣期》模印砖画

清朝·乾隆“瓷母”釉彩大瓶

宋·王希孟《千里江山图》绢本
描述
青铜属于金属材料
砖属于传统无机非金属材料
瓷属于新型无机非金属材料
由蚕丝织成的绢属于天然高分子材料
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关生活中常见有机物和基本营养物质叙述正确的是( )
A.无糖饼干没有甜味,糖尿病患者可随意食用
B.疫苗要求冷链运输,以免温度升高使蛋白质氧化
C.油脂都不能使溴水和酸性KMnO4溶液褪色
D.可通过灼烧区别棉花和羊毛
难度: 简单查看答案及解析
-
下列关于物质用途和反应类型说法正确的是( )
A.用SO2漂白纸张,发生了氧化还原反应
B.用高锰酸钾溶液浸泡过的硅藻土吸收乙烯给水果保鲜,发生了加成反应
C.食醋可加快漂粉精的漂白速率,漂粉精溶液加醋时发生了复分解反应
D.用蛋白质生产肥皂和甘油,发生了水解反应
难度: 简单查看答案及解析
-
下列指定微粒数目一定相等的是( )
A.等质量的15N2与12C16O中的分子数
B.等质量的C2H4与C3H6中含有的碳原子数
C.等体积、等浓度的NH4Cl与(NH4)2SO4溶液中的NH
数
D.等质量的Fe与Cu分别与足量Cl2反应时转移的电子数
难度: 中等查看答案及解析
-
铊(81Tl)是某超导材料的组成元素之一,下列有关叙述正确的是( )
A.Tl位于第五周期第IIIA族
B.离子半径:Cs+>Tl3+
C.
Tl和
Tl互为同素异形体
D.碱性:Al(OH)3>Tl(OH)3
难度: 中等查看答案及解析
-
中医药是中华民族的瑰宝,厚朴酚是一种常见中药的主要成分之一,有抗菌、消炎等功效,其结构简式如图a所示。下列说法错误的是( )
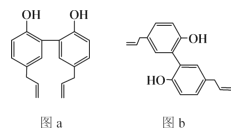
A.厚朴酚与溴可发生加成反应或取代反应
B.图b所示为厚朴酚的一种同分异构体
C.厚朴酚分子中所有碳原子可能共平面
D.1mol厚朴酚最多可跟8molH2发生加成反应
难度: 中等查看答案及解析
-
为解决污染、变废为宝,我国科研人员研究在新型纳米催化剂Na-Fe3O4和HMCM-22的表面将CO2转化为烷烃,其过程如图。
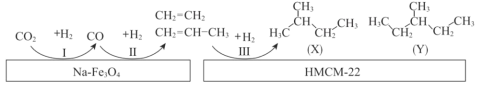
下列说法中,不正确的是( )
A.反应I、II、III均有副产物H2O产生
B.最终产物X、Y属于同系物
C.产物X名称为“2—甲基丁烷”或“异戊烷”
D.产物X、Y都有4种一氯代物(不考虑立体异构体)
难度: 中等查看答案及解析
-
在下列各溶液中,指定的离子组一定能大量共存的是( )
A.无色溶液中:K+、Cu2+、Cl-、SO
B.含有0.1mol·L-1Fe3+的溶液中:K+、Mg2+、I-、NO
C.在pH=1的溶液中:K+、Ba2+、Cl-、NO
D.室温下,
=10-13的溶液中:Na+、Fe3+、NO
、SO
难度: 简单查看答案及解析
-
按如图所示装置进行实验,观察到灵敏电流计指针偏转,图中a、b电极均为铜单质,下列说法正确的是( )
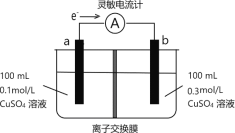
A.该装置的能量转换形式为:电能→化学能
B.b的电极反应为:Cu-2e-=Cu2+
C.溶液中SO
穿过阴离子交换膜发生迁移
D.外电路转移的电子最多为0.01mol
难度: 困难查看答案及解析
-
下列实验方案和实验装置都合理的是( )
编号
A
B
C
D
实验目的
用铜和浓硝酸反应
制取NO2
用标准盐酸测定
烧碱溶液浓度
制取并收集氯气
制乙炔并使之与溴反
应
实验装置
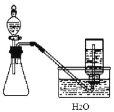
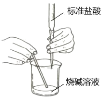

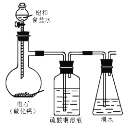
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
T℃时,在1L的密闭容器中充入1molCO2和3molH2,发生反应:CO2(g)+3H2(g)
CH3OH(g)+H2O(g)∆H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是( )
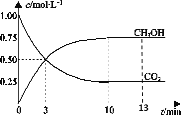
A.T℃时,平衡常数K=3,CO2与H2的平衡转化率相等
B.T℃时,上述条件下达到平衡时放出49.0kJ的热量
C.降温和缩小容器体积均可使反应的平衡常数增大
D.从反应开始到3min,H2的平均反应速率υ(H2)=0.5mol•L-1•min-1
难度: 中等查看答案及解析
-
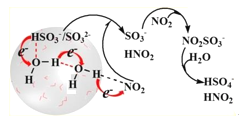
某同学进行如下趣味化学实验:

将HgCl2溶液和KIO3溶液同时加入
反应原理:
①IO
+3HSO
=I-+3SO
+3H+
②IO
+5I-+6H+=3I2+3H2O
③Hg2++2I-=HgI2↓(橙红色)
现象:先产生橙红色沉淀,几秒钟后溶液颜色变为蓝色
下列说法不正确的是( )
A.反应①中IO
表现了氧化性
B.反应①对反应②的进行有促进作用
C.该实验条件下,反应速率:③>②
D.用Na2SO3溶液代替NaHSO3进行实验,现象相同
难度: 中等查看答案及解析
-
近年来我国在天然气脱硫研究方面取得了新进展,利用如图1装置可完成天然气脱硫,甲池中发生反应如图2所示。
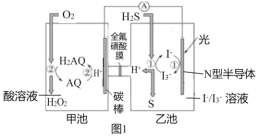

下列关于该装置工作原理的说法中,正确的是( )
A.碳棒为该脱硫装置的负极
B.乙池中发生的反应为:H2S+2e-=S+2H+
C.AQ与H2AQ间的转化属于非氧化还原反应
D.除I
/I-外,Fe3+/Fe2+也能实现如图所示循环过程
难度: 困难查看答案及解析
-
25℃时,向10mL0.10mol·L-1一元弱酸HA(Ka=10-3)中逐滴加入0.10mol·L-1的NaOH溶液,溶液pH随所加NaOH溶液体积变化如图。下列说法不正确的是( )
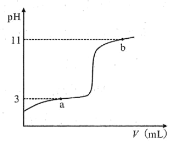
A.a点处存在c(HA)+c(OH-)=c(Na+)+c(H+)
B.b点处存在c(Na+)=c(HA)+c(OH-)+c(A-)
C.由a→b,溶液中n(A-)持续增大
D.V=10mL时,存在c(Na+)>c(A-)>c(OH-)>c(H+)
难度: 困难查看答案及解析



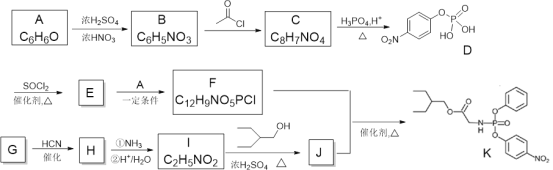
 R—Cl
R—Cl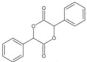 的合成路线_____(溶剂、无机试剂任选)。
的合成路线_____(溶剂、无机试剂任选)。