-
下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3 B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2 D. 硬度:MgO>CaO>BaO
难度: 中等查看答案及解析
-
下列各元素,最易形成离子化合物的组合是
①第三周期第一电离能最小的元素 ②外围电子构型为2s22p6的原子 ③2p能级为半满的元素 ④电负性最大的元素
A.①② B.③④ C.②③ D.①④
难度: 中等查看答案及解析
-
按电子排布,可把周期表里的元素划分成5个区,以下元素属于p区的是( )
A.Fe B.Mg C.P D.Cu
难度: 简单查看答案及解析
-
下列能级轨道数为3的是 ( )
A.s能级 B.p能级 C.d 能级 D.f能级
难度: 简单查看答案及解析
-
下列有关元素周期系的叙述正确的是 ( )
A.元素周期系中ⅠA族元素又称为碱金属元素
B.元素周期系中每一周期元素的种类均相等
C.元素周期系的形成原因是核外电子排布的周期性变化
D.每一周期的元素最外层电子数均是1→8,周而复始
难度: 简单查看答案及解析
-
某元素原子的价电子排布式是3s23p4,则它在周期表中的位置是 ( )
A.第二周期第ⅣA族 B.第三周期第ⅣA族
C.第四周期第ⅡA族 D.第三周期第ⅥA族
难度: 简单查看答案及解析
-
下列化学用语表述正确的是( )
A.Cl-的结构示意图
B.MgCl2的电子式
C.CCl4的结构式
D.高碘酸的分子式H4IO5
难度: 简单查看答案及解析
-
最近科学家制得一种新的分子,它具有空心的类似足球状结构,化学式为C60,下列说法中不正确的是
A.C60是一种单质
B.C60和石墨都是碳的同素异形体
C.C60是一种新型的化合物
D.C60分子是由60个碳原子构成的分子
难度: 简单查看答案及解析
-
下列有关化学用语的表示方法中正确的是( )
A.氯元素的原子结构示意图:
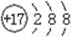 B.N2的结构式:N≡N
B.N2的结构式:N≡NC.原子核内有8个中子的氧原子:
D.二氧化碳的电子式:
难度: 简单查看答案及解析
-
肯定属于同族元素且性质相似的是( )
A.原子核外电子排布式:A为1s22s2,B为1s2
B.结构示意图:A为
,B为
C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D.A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
难度: 中等查看答案及解析
-
下列各能层中不包含p能级的是
A.N B.M C.L D.K
难度: 中等查看答案及解析
-
下列原子或离子原子核外电子排布不属于基态排布的是
A.N: 1s22s22p3 B.S2-: 1s22s22p63s23p6
C.Na: 1s22s22p53s2 D.Si: 1s22s22p63s23p2
难度: 简单查看答案及解析
-
某元素原子的质量数为52,中子数为28,其基态原子未成对电子数为( )
A.1 B.3 C.4 D.6
难度: 简单查看答案及解析
-
用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;三角锥形
C.V形;平面三角形 D.直线形;平面三角形
难度: 简单查看答案及解析
-
下列分子或离子中,中心原子不是sp3杂化的是
A.SO
B.NO
C.CH4 D.H2S
难度: 简单查看答案及解析
-
在d轨道中电子排布成
,而不能排布成
,其最直接的根据是
A.能量最低原理 B.泡利原理 C.原子轨道构造原理 D.洪特规则
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.区分晶体和非晶体的最可靠的科学方法是对固体进行X射线衍射
B.1mol金刚石中的C—C键数是2NA,1molSiO2晶体中的Si—O键数也2NA
C.水晶和干冰在熔化时,晶体中的共价键都会断裂
D.晶体中分子间作用力越大,分子越稳定
难度: 简单查看答案及解析
-
下列关于乙烯(CH2=CH2)的说法不正确的( )
A. 乙烯分子中2个碳原子都是sp2杂化
B. 乙烯分子存在非极性键
C. 乙烯分子中4个H原子在同一平面上
D. 乙烯分子有6个σ键
难度: 中等查看答案及解析
-
下列性质中,能充分说明某晶体是离子晶体的是
A.具有较高的熔点 B.固态不导电,水溶液能导电
C.可溶于水 D.固态不导电,熔融状态能导电
难度: 简单查看答案及解析