-
下列有关硫、氮单质及其化合物的叙述正确的是
A. SO2、NO2均为酸性氧化物
B. “雷雨肥庄稼”与氮的固定有关
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 铜片与稀盐酸不反应,向溶液中通入NO2后,铜片质量不变
难度: 简单查看答案及解析
-
下列说法中不正确的是( )
①将硫酸钡放入水中不能导电,硫酸钡是非电解质;
②氨溶于水得到氨水溶液能导电,氨水是电解质;
③固态氯化氢不导电,液态氯化氢可以导电;
④硫酸氢钠电离出的阳离子有氢离子,硫酸氢钠是酸;
⑤电解质放在水中一定能导电,非电解质放在水中一定不导电。
A. 仅①④ B. 仅①④⑤
C. 仅②③ D. ①②③④⑤
难度: 中等查看答案及解析
-
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,共产生NO气体4.48 L(标准状况),向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全。则下列有关叙述中不正确的是
A.开始加入合金的物质的量之和为0.3mol
B.反应中被还原和未被还原的硝酸物质的量之比为3∶1
C.沉淀完全时消耗NaOH溶液的体积为200mL
D.生成沉淀的质量比原合金的质量增加10.2g
难度: 困难查看答案及解析
-
陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是
A. “雨过天晴云破处”所描述的瓷器青色,来自氧化铁
B. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成
C. 陶瓷是应用较早的人造材料,主要化学成分是硅酸盐
D. 陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
B.标准状况下,2.24 L SO3中所含原子数为0.4NA
C.常温常压下,16g O2和O3的混合气体中所含原子数目为NA
D.在一定条件下,1mol N2与3mol H2反应生成的NH3分子数为2NA
难度: 中等查看答案及解析
-
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
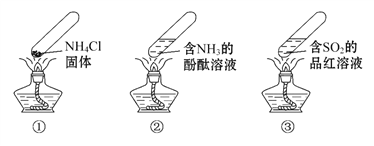
A.加热时,①中上部汇集了NH4Cl固体
B.加热时,②中溶液变红,冷却后又都变为无色
C.加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D.三个“封管实验”中所发生的化学反应都是可逆反应
难度: 中等查看答案及解析
-
同温同压下两相同圆底烧瓶中分别充满①NH3,②NO2倒扣于水中进行喷泉实验,经充分反应后,瓶内溶液的物质的量浓度为
A. ①>② B. ①<② C. ①=② D. 不能确定
难度: 中等查看答案及解析
-
下列实验现象预测正确的是( )
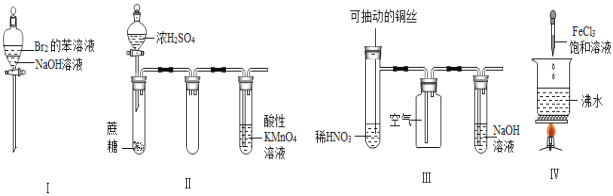
A.实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:滴入FeCl3后,可形成带电的胶体,该分散系导电能力增强
难度: 中等查看答案及解析
-
将0.02mol铜片溶于100mL9mol/LHNO3中,产生336mL气体(只含NO、NO2)。该气体与一定量O2混合后用水恰好完全吸收,则通入的O2体积为(气体体积均为标准状况)
A.22.4mL B.33.6mL C.44.8mL D.224mL
难度: 中等查看答案及解析
-
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是
A.肯定只有SO2 B.肯定没有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
难度: 中等查看答案及解析
-
在指定环境中,下列各组离子一定可以大量共存的是
A.某无色溶液:Fe2+、NO
、SO
、Na+
B.使紫色石蕊试液变红的溶液:NH
、Mg2+、Cl-、K+
C.加入铝粉放出氢气的溶液:Na+、Cl-、NH
、NO3-
D.使无色酚酞试液显红色的溶液:S2-、K+、HCO
、Al3+
难度: 中等查看答案及解析
-
将2.56g铜粉加入100mL0.4mol·L-1的稀HNO3溶液中,加热充分反应后再加入100mL0.2mol·L-1的H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )
A.0.15mol·L-1 B.0.2mol·L-1 C.0.075mol·L-1 D.0.45mol·L-1
难度: 困难查看答案及解析
-
一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2mol•L﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 mol B. 0.25 mol C. 0.3 mol D. 0.35 mol
难度: 困难查看答案及解析
-
用CuS、Cu2S处理酸性废水中的Cr2O
,发生反应如下:
反应Ⅰ:CuS+Cr2O
+H+→Cu2++SO
+Cr3++H2O(未配平)
反应Ⅱ:Cu2S+Cr2O
+H+→Cu2++SO
+Cr3++H2O(未配平)
下列有关说法正确的是( )
A.反应Ⅰ和Ⅱ中Cu2+、SO
都是氧化产物
B.处理1molCr2O
时反应Ⅰ、Ⅱ中消耗H+的物质的量相等
C.反应Ⅱ中还原剂、氧化剂的物质的量之比为3:5
D.反应Ⅰ、Ⅱ中每处理1molCr2O
,转移电子数不相等
难度: 中等查看答案及解析
-
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )

A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
难度: 困难查看答案及解析
-
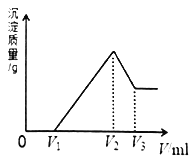
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH
、Cl-、AlO
。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是

A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH
B.反应最后形成的溶液中的溶质含AlCl3
C.原溶液中Al3+与NH
的物质的量之比为1∶3
D.原溶液中含有的阴离子是Cl-、AlO
难度: 中等查看答案及解析