-
中国古代“炼丹术”中蕴含了丰富的化学知识,为近代化学的建立和发展奠定了基础。下列关于“炼丹术”中涉及的史实解释错误的是
选项
史 实
解 释
A
“胡粉[(PbCO3∙Pb(OH2) ]投火中,色坏还为铅(Pb)”
复分解反应原理
B
“有硇水者,剪银塊(Ag) 投之,则旋而为水”
氧化还原反应原理
C.
“曾青(硫酸铜)涂铁,铁赤色如铜……外变而内不化也”
置换反应原理
D
“铁釜代替土釜,加热丹砂(HgS),可增采也”
平衡移动原理
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.13 g13 C含有的中子数目为6 NA
B.常温下 ,I LpH =4的醋酸溶液所含离子总数为2 ×10-4NA
C.100 g质量分数为 98% 的磷酸中所含氧原子总数为4 NA
D.0.1 mol Fe 完全溶于稀硝酸,转移的电子数目为0.3 NA
难度: 简单查看答案及解析
-
对二乙烯苯(
)可用作树脂、油漆及特种橡胶的原料下列说法正确的是
A.分子中所有原子可共平面 B.一氯代物有4种(不考虑立体异构)
C.不能使酸性高锰酸钾溶液褪色 D.1mol该分子最多可与2mol H2加成
难度: 简单查看答案及解析
-
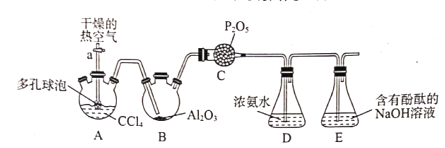
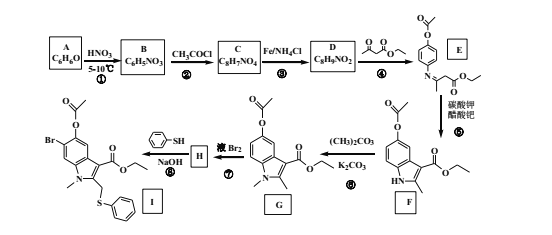
实验室模拟氨催化氧化法制硝酸的装置如图所示。下列说法错误的是
A.装置①、②、⑤依次盛装碱石灰、P2O5、NaOH溶液
B.装置③中产生红棕色气体
C.装置④中溶液可使紫色石蕊溶液变红,说明有HNO3生成
D.通空气的主要作用是鼓出氨气,空气可用N2代替
难度: 简单查看答案及解析
-
短周期主族元素
原子序数依次增大,X均能与其他三种元素形成共价化合物。四种元素组成某正盐M的水溶液遇到三价铁离子时,呈现血红色。下列说法错误的是( )
A.M遇到浓氢氧化钠溶液时,会产生使蓝色石蕊试纸变红的气体
B.Y的某种氢化物可做植物生长调和剂,催熟水果
C.Z的氧化物对应水化物可能是弱酸
D.化合物(WYZ)2中所有原子均满足8电子稳定结构
难度: 中等查看答案及解析
-
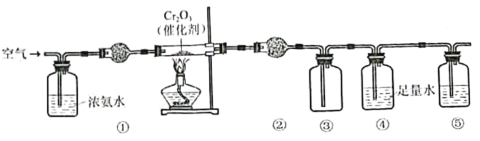
2019年诺贝尔化学奖授予了对锂离子电池方面的研究作出贡献的约翰·B·古迪纳夫(John B.Goodenough)等三位科学家。已知可充电镍酸锂离子电池的工作原理如图所示,其总反应为:
。下列说法不正确的是( )
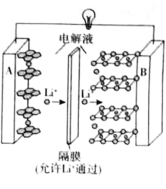
A.放电时,A电极为
作原电池负极
B.放电时,B电极反应式为
C.充电时,A电极反应式为
D.充电时,当电路中通过
电子的电量时,A、B两极质量变化差为
难度: 中等查看答案及解析
-
已知:硫酸银(Ag2SO4)的溶解度大于氯化银且硫酸银(Ag2SO4)的溶解度随温度升高而增大,T℃时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
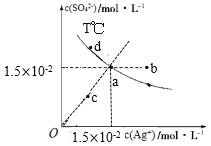
A.a点溶液加入硝酸银固体,则a点可沿虚线移动到b点
B.a点溶液若降低温度,则a点可沿虚线移动到c点
C.向a点的悬浊液中加入NaCl固体,溶液组成可能会由a向d方向移动
D.根据曲线数据计算可知,T℃下,Ksp(Ag2SO4)=2.25×10-4
难度: 中等查看答案及解析