-
以下有关元素性质的说法不正确的是( )
A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4,原子半径最大的是①
B.下列原子的外围电子排布中,①3s23p1②3s23p2③3s23p3④3s23p4,对应的第一电离能最大的是③
C.①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④
D.某元素的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是③ ①X+②X2+③X3+④X4+
难度: 简单查看答案及解析
-
下列各组原子中,彼此化学性质一定相似的是( )
A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子
D.最外层都只有一个电子的X、Y原子
难度: 中等查看答案及解析
-
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3沸点低于NH3沸点,因为P-H键键能低
D.PH3分子稳定性低于NH3分子,因为N-H键键高
难度: 中等查看答案及解析
-
下列各项叙述中,正确的是( )
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.24Cr原子的电子排布式是1s22s22p63s23p63d44s2
难度: 中等查看答案及解析
-
下列不同时期原子结构模型的提出时间排列正确的是( )
①电子分层排布模型 ②“葡萄干布丁”模型 ③量子力学模型 ④道尔顿原子学说 ⑤核式模型
A.①③②⑤④ B.④②③①⑤
C.④②⑤①③ D.④⑤②①③
难度: 简单查看答案及解析
-
在第二周期中,B、C、N、O四种元素的第一电离能由大到小的排列顺序正确的是( )
A.I1(N)>I1(O)>I1(C)>I1(B)
B.I1(N)>I1(O)>I1(B)>I1(C)
C.I1(N)>I1(C)>I1(O)>I1(B)
D.I1(O)>I1(N)>I1(C)>I1(B)
难度: 中等查看答案及解析
-
在d轨道中电子排布成
,而不排布成
,其直接的依据是( )
A.能量最低原理 B.泡利原理 C.原子轨道能级图 D.洪特规则
难度: 简单查看答案及解析
-
短周期主族元素 W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为 4:3,Z 原子比 X 原子的核外电子数多 4。下列说法正确的是
A.W、Y、Z 的电负性大小顺序一定是 Z>Y>W
B.W、X、Y、Z 的原子半径大小顺序可能是 W>X>Y>Z
C.Y、Z 形成的分子空间构型可能是正四面体
D.WY2 分子中
键与π键的数目之比是 2:1
难度: 简单查看答案及解析
-
如图所示是元素周期表的一部分(表中数字和X代表原子序数),其中X的电子排布式为[Ar]3d104s24p5的是( )。
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列推断正确的是( )
A.BF3是三角锥形分子
B.NH4+的电子式:
,离子呈平面形结构
C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键
D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H σ键
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.在NH4+和[Cu(NH3)4]2+中都存在配位键
B.12g金刚石中含有的C—C键的个数为2NA
C.配位数为4的配合物均为正四面体结构
D.向含有0.1mol[Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1molAgCl
难度: 中等查看答案及解析
-
据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为C60Si60,其分子结构好似中国传统工艺品“镂雕”,经测定其中包含C60,也有Si60结构。下列叙述正确的是 ( )
A.该物质有很高的熔点、很大的硬度 B.该物质形成的晶体属于分子晶体
C.该物质分子中Si60被包裹在C60里面 D.该物质的相对分子质量为1200
难度: 中等查看答案及解析
-
下表给出几种氯化物的熔点和沸点:
NaCl
MgCl2
AlCl3
SiCl4
熔点/℃
801
714
190
-70
沸点/℃
1413
1412
180
57.57
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时能升华,②四氯化硅在晶态时属于分子晶体,③氯化钠晶体中粒子之间以范德华力结合,④氯化铝晶体是典型的离子晶体,其中与表中数据一致的是( )
A.①② B.②③ C.①②④ D.②④
难度: 中等查看答案及解析
-
测知氯化钠晶体中相邻的Na+与Cl-的距离为acm,该晶体密度为dg•cm-3,则阿伏加德罗常数可表示为( )
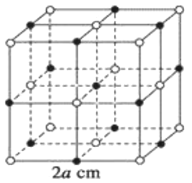
A.
B.
C.
D.
难度: 中等查看答案及解析
-
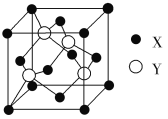
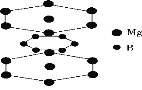
下面的排序不正确的是( )
A.晶体熔点高低:对羟基苯甲醛>邻羟基苯甲醛
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为MgB2
难度: 中等查看答案及解析
-
某元素的一个原子形成的离子可表示为
n-,下列说法正确的是( )
A.
n-中含有的中子数为a+b
B.
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为
g
难度: 简单查看答案及解析
-
A、B、C、D、E五种短周期元素,其原子序数逐渐增大。元素A的单质是密度最小的气体,元素B的单质存在两种以上同素异形体,且其中一种是自然界中硬度最大的单质,元素D的最外层电子数是次外层电子数的三倍。B、C、D、E四种元素均能与A形成电子数相等的四种分子,且化合物中各原子的个数比如下表:
化合物
甲
乙
丙
丁
原子个数比
B∶A=1∶3
C∶A=1∶2
D∶A=1∶1
E∶A=1∶1
下列说法正确的是( )
A.元素E在元素周期表中的位置为第二周期第ⅦA族
B.原子半径:A<B<C<D
C.A、C、E中三种元素或任意两种元素形成的物质中只可能含有共价键
D.A、B、C、D四元素中的三种能形成多种与甲分子电子数相等的化合物
难度: 困难查看答案及解析
-
下列有关说法不正确的是( )
A.
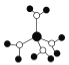 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键B.
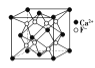 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+C.
 H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动D.
 金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12难度: 简单查看答案及解析
-
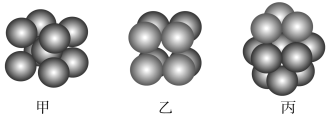
关于下列四种金属堆积模型的说法正确的是( )
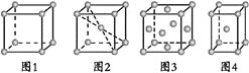
A.图1和图4为非密置层堆积,图2和图3为密置层堆积
B.图1~图4分别是简单立方堆积、体心立方堆积、面心立方堆积、体心立方堆积
C.图1~图4每个晶胞所含有原子数分别为1、2、2、4
D.图1~图4堆积方式的空间利用率分别为52%、68%、74%、74%
难度: 中等查看答案及解析
-
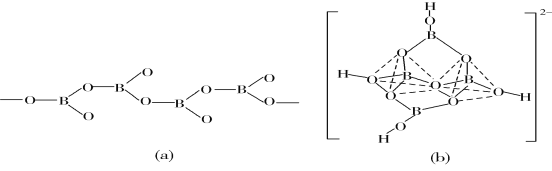
胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
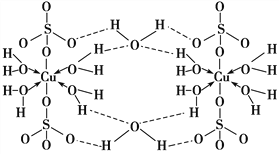
下列有关胆矾的说法正确的是( )
A.所有氧原子都采取sp3杂化 B.氧原子参与形成配位键和氢键两种化学键
C.Cu2+的价电子排布式为3d84s1 D.胆矾中的水在不同温度下会分步失去
难度: 困难查看答案及解析