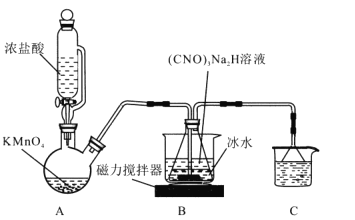
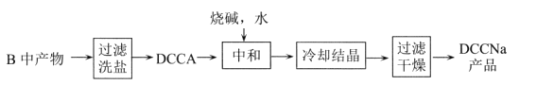
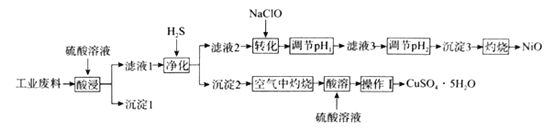
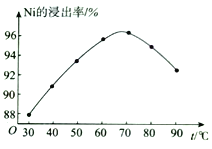
-
2020 年春节前后,新冠病毒肆虐全球,防控疫情已成为国际首要大事。按照以往对冠状病毒的经验,乙醚、75%乙醇、含氯的消毒剂、过氧乙酸等均可有效灭活病毒,下列有关说法错误的是( )
A.因乙醇易燃,不可使用酒精溶液大面积对室内空气进行消毒
B.过氧乙酸(CH3COOOH)用于杀灭病毒是因为其含有羧基
C.次氯酸钠具有一定的腐蚀性和刺激性,使用时需带手套,并稀释使用
D.不能将“84 消毒液”和酒精混合进行环境消毒
难度: 简单查看答案及解析
-
我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
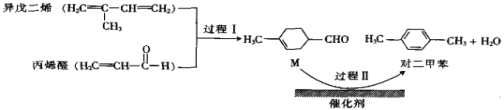
下列说法不正确的是( )
A.M的某种同分异构体含有苯环且能与钠反应放出氢气
B.可用溴水鉴别M和对二甲苯
C.对二甲苯的一氯代物有2种
D.异戊二烯所有碳原子可能共平面
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
已知氢化钠(NaH)可由氢气和钠在高温下化合形成,其使用需要惰性环境,遇水放出易燃气体,下列说法不正确的是( )
A.氢化钠与水反应产生的气体,通过盛有碱石灰的干燥管,用向下排空气法可以收集得到一定量的H2
B.氢化钠与水反应产生的气体通过灼热的氧化铜,若出现黑色变红色现象,则说明产生的气体中一定含有H2
C.氢化钠在无水条件下除去钢铁表面铁锈的反应方程式为3 NaH+Fe2O3═2Fe+3NaOH
D.锌和盐酸反应后的气体经浓硫酸干燥后,与钠在高温下反应得到纯净的NaH
难度: 困难查看答案及解析
-
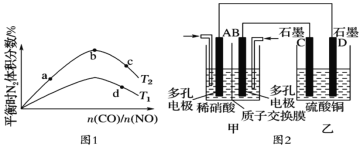
常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
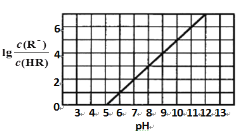
A. 0.1mol·L-1HR溶液的pH为5
B. HR为弱酸,常温时随着氨气的通入,c(R-)/[c(OH-).c(HR)] 逐渐增大
C. 当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
D. 当c(R-)= c(HR)时,溶液必为中性
难度: 困难查看答案及解析
-
电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
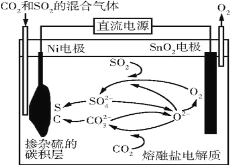
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
难度: 中等查看答案及解析
-
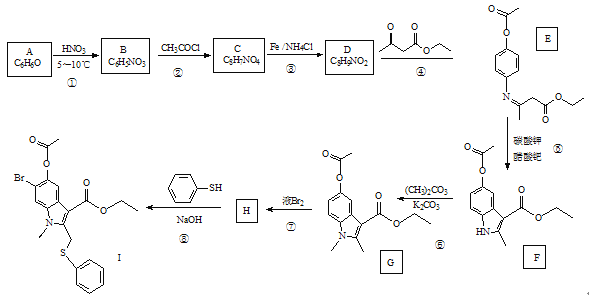
一种用于合成治疗免疫疾病药物的物质,其结构如图所示,其中X、Y,Z、Q、W为1~20号元素且原子序数依次增大,Z与Q同主族,Q和W的简单离子具有相同的电子层结构。下列叙述正确的是
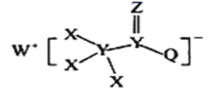
A.WX是共价化合物
B.最高价氧化物对应的水化物的酸性:Q<Y
C.原子半径:W>Z>Y
D.Z和X、Y、W、Q均形成至少两种二元化合物
难度: 中等查看答案及解析