-
根据SO2通入不同溶液中实验现象,所得结论不正确的是
实验
现象
结论
A
含HCl、BaCl2的FeCl3溶液
产生白色沉淀
SO2 有还原性
B
H2S 溶液
产生黄色沉淀
SO2 有氧化性
C
酸性KMnO4溶液
紫色溶液褪色
SO2 有漂白性
D
Na2SiO3溶液
产生胶状沉淀
酸性:H2SO3> H2SiO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 中等查看答案及解析
-
下列关于硅酸及其盐的叙述不正确的是( )
A.硅酸是一种弱酸,可由其酸性氧化物SiO2与水化合而制得
B.硅酸盐是构成地壳中岩石的主要成分,黏土的主要成分是硅酸盐
C.硅酸钠的水溶液俗称水玻璃,具有黏合性
D.高岭石的化学式为Al2Si2O5(OH)4,可以表示为Al2O3·2SiO2·2H2O
难度: 简单查看答案及解析
-
世界气候大会于2009年12月在丹麦首都哥本哈根召开。会议的主题是“促进低碳经济,减少CO2的排放”。下列行为中不符合这一主题的是
A.开发新能源,如太阳能、风能等,减少对化石能源的依赖
B.限制化工发展,关停化工企业,消除污染源头
C.加快研发利用二氧化碳合成聚碳酸酯类可降解塑料
D.推广煤的气化、液化技术,提供清洁燃料和化工原料
难度: 简单查看答案及解析
-
硅被誉为无机非金属材料的主角。据2001年12月的《参考消息》报道,有科学家提出硅是“21世纪的能”、“未的石油”。下列有关说法正确的是
A.硅在地壳中含量居第二位,在地球上有丰富的硅资,如石英、水晶、玛瑙的主要成分都是单质硅
B.在野外,用硅、烧碱的混合物可以制取氢气
C.硅的性质稳定,不与任何酸反应
D.硅是一种良好的半导体材料,所以是制造光导纤维的基本原料
难度: 中等查看答案及解析
-
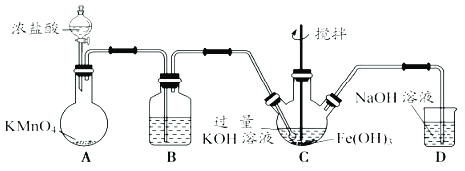
已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用下图所示的实验装置来制备纯净、干燥的氯气,并实验其与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
A.①和②处 B.只有②处
C.②和③处 D.②、③、④处
难度: 中等查看答案及解析
-
下列实验现象和结论一致,正确的是
A.氯水加入有色布条,有色布条褪色,说明溶液中有Cl2存在
B.氯水溶液呈黄绿色,有刺激性气味,说明有Cl2存在
C.氯水加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在
D.氯水加入NaOH溶液,氯水黄绿色消失,说明有HClO存在
难度: 中等查看答案及解析
-
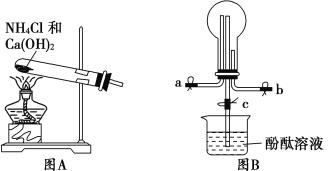
如图所示是实验室制取氨气的装置,其中错误的是( )
A.
 B.
B.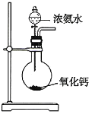 C.
C.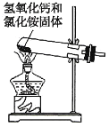 D.
D.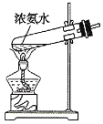
难度: 简单查看答案及解析
-
潮湿的氯气,新制的氯水,漂白粉水溶液均能使有色布条褪色,这是由于它们含有或能生成( )
A.氯气 B.次氯酸 C.次氯酸根离子 D.氯化氢
难度: 简单查看答案及解析
-
赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是
A.盐酸 B.烧碱 C.氢氟酸 D.纯碱
难度: 简单查看答案及解析
-
水处理包括水的净化、杀菌消毒、蒸馏等.其中常见的杀菌消毒剂包括氯气、臭氧、漂白粉、活性炭等,游泳场馆往往用臭氧、活性炭对游泳池进行消毒和净化。下列说法中正确的是( )
A.臭氧、活性炭处理水的原理相同
B.氯气是一种常用的消毒剂,用氯气消毒的水也可以用于配制各种化学试剂
C.氯气和二氧化硫都具有漂白性,等体积的两者混合会提高漂白的效率
D.漂白粉长期露置在空气中会失效
难度: 简单查看答案及解析
-
高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2
Si(粗)
SiHCl3
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
难度: 中等查看答案及解析
-
将氯水分别滴入下列溶液中,由实验现象得出的结论正确的是( )
选项
氯水滴入下列溶液中
实验现象
结论
A
滴有KSCN的FeCl2溶液
变红
Cl2具有还原性
B
滴有酚酞的NaOH溶液
褪色
Cl2具有酸性
C
紫色石蕊溶液
先变红后褪色
Cl2具有漂白性
D
淀粉—KI溶液
变蓝色
Cl2具有氧化性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某温度下,将Cl2通入NaOH溶液时,反应得到NaCl、NaClO、NaClO3的混合溶液,经测定混合溶液中,ClO-与ClO3-的物质的量浓度之比为3∶1,则Cl2与NaOH溶液反应时,被氧化的氯元素与被还原的氯元素质量之比是
A.2∶1 B.1∶3 C.1∶2 D.3∶11
难度: 中等查看答案及解析
-
下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )

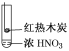
①
②
③
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
难度: 困难查看答案及解析
-
Cl2O是黄棕色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会发生燃烧并爆炸。制取Cl2O的装置如图所示。
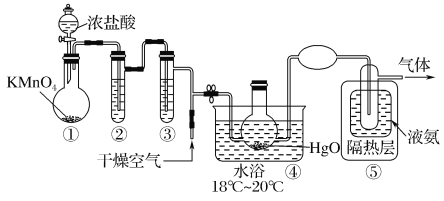
已知:Cl2O的熔点为-116℃,沸点为3.8℃,Cl2的沸点为-34.6℃;HgO+2Cl2=HgCl2+Cl2O
下列说法不正确的是( )
A.装置②、③中盛装的试剂依次是饱和食盐水和浓硫酸
B.通入干燥空气的目的是将生成的Cl2O稀释减少爆炸危险
C.从装置⑤中逸出气体的主要成分是Cl2O
D.装置④与⑤之间不用橡皮管连接,是为了防止橡皮管燃烧和爆炸
难度: 中等查看答案及解析
-
海水开发利用的部分过程如图所示。下列说法错误的是
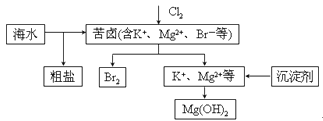
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
由二氧化硅制高纯硅的流程如图,下列判断中错误的是( )
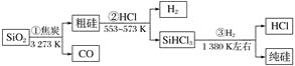
A.①②③均属于氧化还原反应 B.氢气和氯化氢均可循环利用
C.二氧化硅是一种坚硬难熔的固体 D.三氯甲硅烷(SiHCl3)摩尔质量为135.5 g
难度: 中等查看答案及解析
-
已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③实验②生成的溶液滴在KI试纸上,试纸变蓝
下列判断正确的是( )
A.上述实验证明氧化性:
>Cl2>Fe3+>I2
B.上述实验中共有两个氧化还原反应
C.实验①生成的气体不能使湿润的KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
难度: 中等查看答案及解析
-
某化学小组用如图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是( )
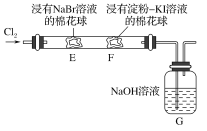
A.E处棉花球变成黄色,说明Cl2的氧化性比Br2强
B.F处棉花球变成蓝色,说明Br2的氧化性比I2强
C.E处发生反应的离子方程式为:Cl2+2Br-===2Cl-+Br2
D.G装置中NaOH溶液与Cl2反应的离子方程式为:2OH-+Cl2===ClO-+Cl-+H2O
难度: 困难查看答案及解析