-
下列叙述不正确的是( )
A.根据一次能源和二次能源的划分,氢气为二次能源
B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C.火力发电时,化学能转化为热能的过程实际上是氧化还原反应的过程,伴有能量的变化
D.水力发电是将燃料中的化学能直接转化为电能的过程
难度: 中等查看答案及解析
-
下列物质分子中,属于正四面体结构的是( )
A.CH3Cl B.CHCl3 C.CH2Cl2 D.CCl4
难度: 简单查看答案及解析
-
为将反应2Al+6H+=2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)( )
A.
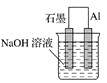 B.
B.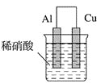
C.
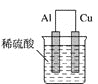 D.
D.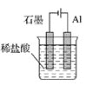
难度: 简单查看答案及解析
-
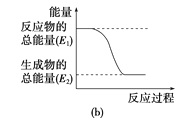
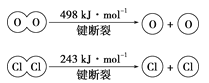
反应N2(g)+O2(g)=2NO(g)的能量变化如图所示。
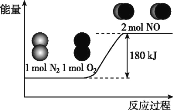
已知:断开1molN2(g)中化学键需吸收946kJ能量,断开1molO2(g)中化学键需吸收498kJ能量。下列说法正确的是( )
A.N2和O2的总能量一定高于NO的总能量
B.2NO(g)=N2(g)+O2(g),该反应为吸热反应
C.断开1molNO(g)中化学键需吸收90kJ能量
D.形成1molNO(g)中化学键可释放632kJ能量
难度: 中等查看答案及解析
-
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是( )
A.盐酸和NaOH溶液混合 B.氯化氢溶于水
C.锌和稀硫酸反应 D.氨气与氯化氢气体相遇反应
难度: 简单查看答案及解析
-
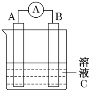
如图是锌片和铜片在稀硫酸中所组成的原电池装置,c、d为两个电极。下列有关的判断不正确的是( )
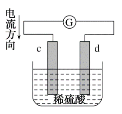
A.电池工作的过程中,溶液中SO
浓度基本不变
B.电池工作时,溶液中SO
向c移动
C.c为负极,发生氧化反应
D.电池工作的过程中,c电极上产生气泡
难度: 简单查看答案及解析
-
反应A+3B=2C+D在四种不同情况下的反应速率分别为①v(A)=0.15mol·L-1·s-1 ②v(B)=0.6mol·L-1·s-1 ③v(C)=0.5mol·L-1·min-1 ④v(D)=0.45mol·L-1·s-1。则反应进行由快到慢的顺序为( )
A.④>③>①>② B.④>②>①>③
C.②>③>④>① D.④>③>②>①
难度: 简单查看答案及解析
-
少量铁粉与100mL0.01mol·L-1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③加NaCl固体 ④加CuO固体 ⑤滴入几滴浓盐酸 ⑥升高温度(不考虑盐酸挥发) ⑦滴加几滴硫酸铜溶液
A.①⑤⑦ B.⑤⑥ C.③⑦ D.③⑥⑦
难度: 中等查看答案及解析
-
X、Y、Z为短周期元素,X原子的最外层只有一个电子,Y原子的最外层电子数比内层电子总数少4,Z原子的最外层电子数是内层电子数的三倍。下列有关叙述正确的是( )
A.X、Y、Z三种元素可形成化合物X2YZ4
B.X、Y两元素形成的化合物只能为离子化合物
C.氢化物的熔沸点:Y>Z
D.氢化物的稳定性:Y>Z
难度: 中等查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)⇌2AB(g)达到平衡的标志是( )
A.单位时间内生成nmolA2同时生成nmolAB
B.容器内气体的总物质的量不随时间而变化
C.单位时间内生成nmolA2的同时生成nmolB2
D.单位时间内生成2nmolAB的同时生成nmolB2
难度: 简单查看答案及解析
-
取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气(如图),下列对于试管内发生的反应及现象的说法正确的是( )
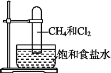
A.此反应无光照也可发生
B.甲烷和Cl2反应后的产物只有CH3Cl和HCl
C.CH4和Cl2完全反应后液面上升,液体充满试管
D.盛放饱和食盐水的水槽底部会有少量晶体析出
难度: 简单查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由小到大的顺序是( )
A.①③④② B.③④②① C.③①②④ D.②④③①
难度: 简单查看答案及解析
-
微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法不正确的是( )
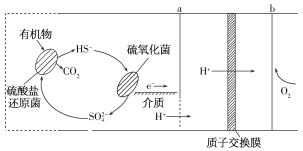
A.电子从a流出,经外电路流向b
B.HS-在硫氧化菌作用下转化为SO42-的反应是HS-+4H2O-8e-= SO42- +9H+
C.如果将反应物直接燃烧,能量的利用率不会变化
D.若该电池电路中有0.4mol电子发生转移,则有0.4molH+通过质子交换膜
难度: 中等查看答案及解析
-
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2→CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
实验
序号
初始浓度c/mol∙L-1
溴颜色消失
所需时间t/s
CH3COCH3
HCl
Br2
①
0.80
0.20
0.0010
290
②
1.60
0.20
0.0010
145
③
0.80
0.40
0.0010
145
④
0.80
0.20
0.0020
580
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大 B.增大c(Br2),v(Br2)增大
C.增大c(HCl),v(Br2)增大 D.实验②和③的v(Br2)相等
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述不正确的是( )
①平衡时,υ正(O2)=υ逆(O2)必成立
②关系式5υ正(O2)=4υ逆(NO)总成立
③用上述四种物质NH3、O2、NO、H2O表示正反应速率的数值中,υ正(H2O)最大
④若投入4molNH3和5molO2,通过控制外界条件,必能生成4molNO
A.①② B.②③ C.①③ D.②④
难度: 简单查看答案及解析
-
在一定条件下,将3molA和1molB两种气体混合于容积为2L的恒容密闭容器中,发生如下反应:3A(g)+B(g)
xC(g)+2D(g)。2min末该反应达到平衡,测得生成0.8molD和0.4molC。下列判断正确的是( )
A.x=2
B.2min时,A的浓度为0.9mol·L-1
C.2min内B的平均反应速率为0.3mol·L-1·min-1
D.B的转化率为60%
难度: 中等查看答案及解析