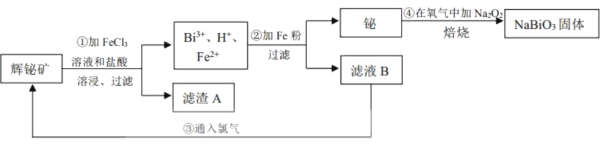
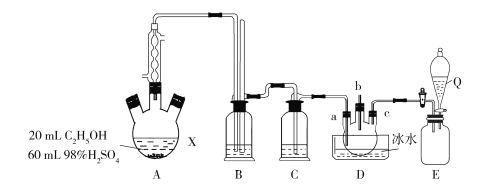
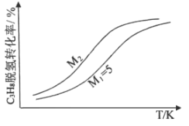
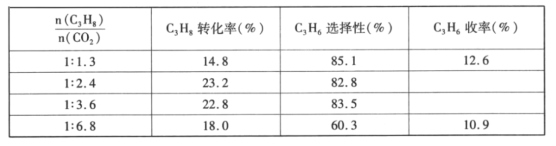
-
2020年1月武汉爆发新冠肺炎,湖北省采取封城封镇的措施阻止了冠状病毒蔓延。新冠病毒主要传播方式是经飞沫传播、接触传播(包括手污染)以及不同大小的呼吸道气溶胶近距离传播。冠状病毒对热敏感,56℃30分钟、75%酒精、含氯消毒剂、过氧乙酸、乙醚和氯仿等脂溶剂均可有效灭活病毒。下列有关说法正确的是( )
A.因为过氧乙酸能灭活病毒,所以在家每天进行醋熏能杀死家里的新冠肺炎病毒
B.电解食盐水制取次氯酸钠喷洒房间能杀死新冠肺炎病毒
C.在空气质量检测中的PM2.5,属于气溶胶
D.含氯消毒剂、过氧乙酸、乙醚和氯仿等都属于有机物
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.1L0.lmol/L的Na2SiO3溶液中含阴离子总数为0.1NA个
B.0.1mol的2H37Cl分子的中子数是2.1NA
C.7.8gNa2O2与足量水充分反应转移的电子数目为0.2NA
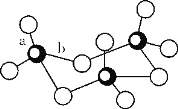
D.1mol雄黄(As4S4),结构如图:
,含有4NA个S-S键
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z原子序数依次增大,W、X的简单离子具有相同的电子层结构,X的原子半径是短周期主族元素原子中最大的,Y的原子序数是W的2倍,Z与X形成的离子化合物的水溶液呈中性。下列说法一定正确的是( )
A. Z的氧化物的水化物的酸性比Y的强
B. 氢元素与W只能形成一种化合物
C. W的简单离子的半径比X的大
D. Y的简单气态氢化物的热稳定性比W的强
难度: 中等查看答案及解析
-
下列实验现象与实验操作不相匹配的是( )
选项
实验操作
实验现象
A
在Fe(NO3)2溶液中滴加酸化的H2O2
浅绿色变黄色
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
C
向盛有硝酸银溶液的试管中
逐渐滴入浓氨水
产生白色沉淀,且白色沉淀不溶解
D
向盛Na2SO3溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量
试管中溶液先变红后褪色
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下图是我国学者研发的高效过氧化氢一尿素电池的原理装置:
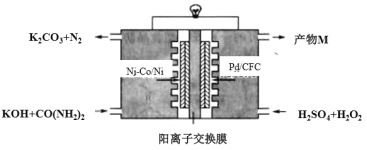
该装置工作时,下列说法错误的是
A.Ni-Co/Ni极上的电势比Pd/CFC极上的低
B.向正极迁移的主要是K+,产物M主要为K2SO4
C.负极反应为:CO(NH2)2+8OH–-6e–=CO32–+N2↑+6H2O
D.Pd/CFC极上发生反应:H2O2+2e–=2OH–
难度: 中等查看答案及解析
-
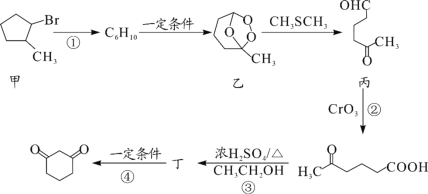
阿巴卡韦(Abacavir)是一种核苷类逆转录酶抑制剂,存在抗病毒功效。关于其合成中间体M(
),下列说法正确的是( )
A.与环戊醇互为同系物
B.分子中所有碳原子共平面
C.能使酸性高锰酸钾溶液和溴水褪色,且反应类型相同
D.可用碳酸钠溶液鉴别乙酸和M
难度: 简单查看答案及解析
-
常温下,向20mL0.1mol/L NaHA(酸式盐)溶液中分别滴加0.1mol/L 盐酸或0.1mol/L NaOH溶液,溶液的pH与滴加溶液体积关系如图所示。下列推断正确的是( )
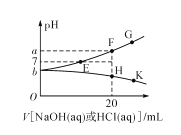
A.NaHA在水中电离程度大于水解程度
B.在对应的各点溶液中,H点水电离程度最大
C.E点对应的溶液中有c(Na+)=c(HA-)+c(A2-)
D.F点对应的溶液中存在c(H+)+c(Na+)=(OH-)+c(HA-)+c(A2-)
难度: 中等查看答案及解析