-
三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是( )
A. 三种气体质量相等
B. 三种气体的物质的量之比为16∶2∶1
C. 三种气体压强比为16∶2∶1
D. 三种气体体积比为1∶8∶16
难度: 简单查看答案及解析
-
将a mL NO、b mL NO2、x mL O2混合于同一试管中,将试管倒插入水中,待气体与水充分反应后,试管内的气体全部消失,则x对a、b的函数关系式x=f(a,b)为( )
A.
B.
C.
D.
难度: 困难查看答案及解析
-
用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++SO
=H2O+SO2↑的反应个数有( )
A. 4个 B. 5个 C. 8个 D. 12个
难度: 中等查看答案及解析
-
有8 g Na2O2、Na2O、Na2CO3、NaOH的混合物与200 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为( )
A. 8 g B. 15.5 g C. 11.7 g D. 无法计算
难度: 中等查看答案及解析
-
4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:
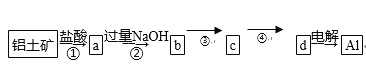
下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
难度: 中等查看答案及解析
-
某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
A. ①③ B. ①②③ C. ③④ D. ②③
难度: 困难查看答案及解析
-
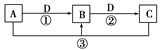
A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(其他产物已略去),下列说法正确的是( )

A. 若X为Fe,则C可能为Fe(NO3)2
B. 若X为KOH溶液,则A可能为Al
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
难度: 中等查看答案及解析