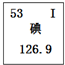
-
保持氢气化学性质的最小粒子是( )
A.H2
B.H2O
C.H
D.H+难度: 中等查看答案及解析
-
近期,英国科学家造出“干水”.“干水”的每个颗粒内部是一颗水滴,外层是二氧化硅.下列有关判断正确的是( )
A.水与二氧化硅发生化学反应生成“干水”
B.“干水”是混合物
C.每个颗粒的“干水”中只含有一个水分子
D.“干水”与干冰成分相同、状态不同难度: 中等查看答案及解析
-
装修房屋用到的下列材料,属于有机合成材料的是( )
A.大理石
B.沙土
C.铝合金
D.塑料水管难度: 中等查看答案及解析
-
香烟烟气中含有一种极易与人体血红蛋白结合的有毒气体,该气体是( )
A.O2
B.N2
C.CO
D.CO2难度: 中等查看答案及解析
-
下列实验事故处理正确的是( )
A.可燃性气体大量泄漏时,立即接通电源用排气扇排气
B.酒精灯中的酒精洒在桌上燃烧起来,立即用湿抹布扑盖
C.氢氧化钠溶液沾到皮肤上,直接涂上浓盐酸
D.少量浓硫酸沾到皮肤上,用大量水冲洗,然后涂上浓氢氧化钠溶液难度: 中等查看答案及解析
-
实验室配制100g质量分数为4%的氢氧化钠溶液,下列描述正确的是( )
A.计算需氢氧化钠4g、水100g
B.将氢氧化钠固体放于纸上称量
C.把氢氧化钠固体放入量筒中溶解
D.将配好的氢氧化钠溶液装瓶并密封保存难度: 中等查看答案及解析
-
某课外活动小组取刚降到地面的雨水水样,用pH计(测pH的仪器)每隔5min测一次该水样的pH,数据如下表.已知酸雨的pH<5.6,下列说法错误的是( )
测定时刻 5:05 5:10 5:15 5:20 5:25 5:30 pH 4.95 4.94 4.92 4.88 4.86 4.85
A.测定的时间内该水样的酸性减弱
B.该雨水是酸雨
C.该取样地点的空气可能受污染
D.用pH试纸不能测得表中数据难度: 中等查看答案及解析
-
8、氯化铵和硫酸钠溶解度曲线如下图所示,从图中获取信息正确的是( )

A.20℃~40℃,氯化铵的溶解度大于硫酸钠
B.两种物质溶解度都随温度升高而增大
C.45℃时两种物质饱和溶液的溶质质量分数相等
D.将50℃的硫酸钠饱和溶液降至20℃,始终没有晶体析出难度: 中等查看答案及解析
-
9、如下图所示,将足量的某铁粉用水均匀地粘在试管内壁上,将试管倒立在装有水的烧杯中.实验过程中,观察到试管内液面缓慢上升.下列分析错误的是( )

A.水能进入试管的最大体积约为试管容积的1/5
B.该铁粉在试管内发生了氧化反应
C.这一实验可以验证空气的组成不是单一的
D.如把该铁粉改为木炭粉,两者的现象完全相同难度: 中等查看答案及解析
-
往盛有稀硫酸的烧杯中加入足量的氧化铜粉末,充分反应后,再向烧杯中继续加入某种金属.实验过程中,烧杯中硫酸铜的质量随时间变化如下图所示(不考虑其他因素对烧杯中物质的影响).下列判断错误的是( )

A.从0到t3,烧杯中水的质量不断增加
B.t1时与t2时烧杯中物质总质量相等
C.加入的金属一定是银
D.从t3到t4,硫酸铜质量变化可通过置换反应实现难度: 中等查看答案及解析